
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式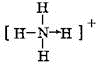 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,C形成-2价阴离子,则C为氧元素,D为镁元素,核电荷数B<C,则B为氮元素;其中A、B、C是同一周期的非金属元素,AC2为非极性分子,则A为碳元素;E的原子序数为24,则E为Cr元素;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3,以此解答该题.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中应存在氢键,C形成-2价阴离子,则C为氧元素,D为镁元素,核电荷数B<C,则B为氮元素;其中A、B、C是同一周期的非金属元素,AC2为非极性分子,则A为碳元素;E的原子序数为24,则E为Cr元素;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3,
故A为碳元素;B为氮元素;C为氧元素,D为镁元素,E为Cr元素,
(1)A为碳元素、B为氮元素、C为氧元素,同周期自左而右第一电离能增大,氮元素原子2p能级有3个电子,处于半满稳定状态,电子能量低,氮元素第一电离能高于相邻的元素的,所以第一电离能由小到大的顺序为C<O<N,
故答案为:C<O<N;
(2)B为N元素,对应的氢化物为氨气,故其电子式为: ,NH4+结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,其结构式为:
,NH4+结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,其结构式为: ,
,
故答案为: ;配位;
;配位; ;
;
(3)一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O,CN-电子式为 ,O22+电子式为
,O22+电子式为 ,一个O22+中含有两个π键,所以1molO22+中含有的π键数目为2mol,
,一个O22+中含有两个π键,所以1molO22+中含有的π键数目为2mol,
故答案为:N2O; ;2;
;2;
(4)E为Cr元素,该配合物为[Cr(NH3)4(H2O)2]Cl3,故答案为:Cr;[Cr(NH3)4(H2O)2]Cl3;
(5)B的最高价氧化物对应的水化物的稀溶液是硝酸,稀硝酸和Mg反应时B被还原到最低价,则B元素的生成物是硝酸铵,同时镁生成硝酸镁,化学方程式为4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O.
点评 本题综合性较大,涉及结构性质越位置关系、元素周期律、电子式与核外电子排布、配合物与杂化理论、分子结构,氧化还原反应等,难度中等,是物质结构的综合性题目,是对学生综合能力的考查,氢化物的沸点比它们同族相邻周期元素氢化物的沸点高是推断的突破口.


科目:高中化学 来源: 题型:解答题
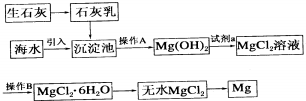
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
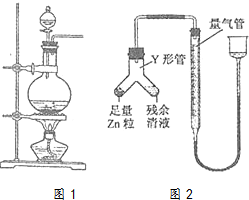 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2为V形的极性分子 | |
| B. | SO2与O3互为等电子体 | |
| C. | NaCl的晶格能高于KCl | |
| D. | 第一电离能由高到低的顺序为:F>O>N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| C. | 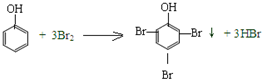 | |
| D. | CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
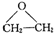 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$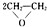 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com