
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,实验室中用下图所示装置制备1,2—二溴乙烷。其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。(夹持装置已略去)
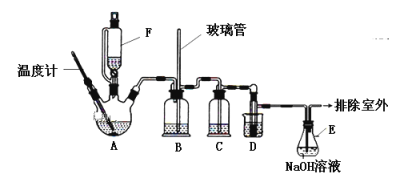
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 / gcm-3 | 0.79 | 2.2 | 0.71 |
沸点 / ℃ | 78.5 | 132 | 34.6 |
熔点 / ℃ | 一l30 | 9 | —1l6 |
填写下列空白:
(1)A的仪器名称是__________________,
(2)A中发生反应的化学方程式为__________________________,D中发生反应的化学方程式为_____________________________________________________________;
(3)在装置C中应加入_________(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量副产物乙醚,可用________________(填操作名称)的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___________________。
【答案】三颈烧瓶 CH3CH2OH![]() CH2=CH2↑+H2OCH2=CH2+Br2→CH2BrCH2Br c蒸馏1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞
CH2=CH2↑+H2OCH2=CH2+Br2→CH2BrCH2Br c蒸馏1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞
【解析】
乙醇与浓硫酸的混合液加热到170℃发生消去反应生成CH2=CH2;由于浓硫酸具有强氧化性,乙醇具有还原性,浓硫酸与乙醇会发生氧化还原反应生成CO2、SO2、H2O,同时乙醇在浓硫酸存在140℃时脱水生成乙醚,所以制得的CH2=CH2中混有乙醚、CO2、SO2等杂质气体;由于SO2也能与Br2发生反应,所以气体在通入D中试管之前必须除去乙烯中混有的酸性气体。
(1)根据A的仪器的结构特点,A的仪器名称为三颈烧瓶。
(2)A中发生的主要反应为乙醇的消去反应,反应的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O。D中发生的反应为:乙烯与Br2加成制备1,2—二溴乙烷,反应的化学方程式为CH2=CH2+Br2→BrCH2CH2Br。
CH2=CH2↑+H2O。D中发生的反应为:乙烯与Br2加成制备1,2—二溴乙烷,反应的化学方程式为CH2=CH2+Br2→BrCH2CH2Br。
(3)由于浓硫酸具有强氧化性,乙醇具有还原性,浓硫酸与乙醇会发生氧化还原反应生成CO2、SO2、H2O,A中制得的CH2=CH2中混有CO2、SO2等气体,由于SO2也能与Br2反应,所以装置C中的试剂用于除去CH2=CH2中混有的酸性气体。a项,水不能将酸性气体完全吸收;b项,浓硫酸不能吸收CO2、SO2;c项,NaOH溶液能将CO2、SO2完全吸收;d项,饱和NaHCO3溶液只能吸收SO2,不能吸收CO2;要将生成的酸性气体完全吸收应选用NaOH溶液,答案选c。
(4)根据表中提供的1,2—二溴乙烷和乙醚的物理性质,1,2—二溴乙烷和乙醚为互相混溶、沸点差别较大的液体混合物,所以用蒸馏法除去1,2—二溴乙烷中少量的乙醚。
(5)根据表中提供的1,2—二溴乙烷的熔点,1,2—二溴乙烷的凝固点较低(9℃),若过度冷却,会使1,2—二溴乙烷凝固而使导管堵塞。


科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量(已知电子的电荷量为1.6×10-19C),以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是

A. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
B. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
C. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2- + 6H2O
D. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几组物质:
①35Cl和37Cl ②石墨与C60 ③CH4和CH3CH2CH3 ④CH3CH=CH2和CH2=CHCH=CH2
⑤![]() 和
和 ![]() ⑥CH3CH(CH3)2和
⑥CH3CH(CH3)2和 ![]() ⑦
⑦![]() 和
和![]()
(1)互为同位素的是__________(填序号,下同),
(2)互为同分异构体的是__________,
(3)互为同系物的是__________,
(4)互为同素异形体的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体含氧65%、碳18%、氢10%、氮3%、钙1.5%、磷1%、钾0.35%、硫0.25%、钠0.15%、氯0.15%、镁0.05%,它们被称为人体常量元素。
(1)人体的构成元素中,从周期表来看,元素数目最多的为________ 族。属于第三周期的非金属元素的原子半径由大到小的顺序________。
(2)上述元素中有两种在第ⅥA族,它们的活动性相比较_______>_______(用元素符号表示)。
(3)含量前3位的元素形成的一种有机物名称是__________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH-CH2OH)可发生的化学反应有( )
①加成反应②氧化反应③置换反应④加聚反应⑤取代反应
A. ①②③④B. ②④⑤C. ①②③④⑤D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素成果而获得2015年诺贝尔生理学或医学奖。青蒿素和双氢青蒿素结构如下图所示,结构中含有和双氧水(H-O-O-H)类似的“-O-O-”过氧键。
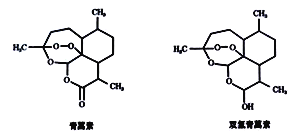
下列关于青蒿素和双氢青蒿素的说法正确的是
A. 青蒿素和双氢青蒿素均能杀菌消毒,且均可以使得酸性高锰酸钾褪色
B. 青蒿素和双氢青蒿素完全燃烧的耗氧量相同
C. 青蒿素通过氧化反应可制得双氢青蒿素
D. 青蒿素和双氢青蒿素在稀硫酸催化条件下均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下(氯化过程中少量Ca(ClO)2 分解为CaCl2和O2):
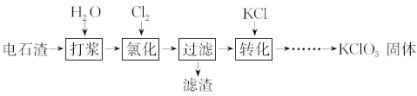
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①生成Ca(ClO)2的化学方程式为__________________________________________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。请回答:
①滤渣的主要成分为__________(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] :n[CaCl2]________1∶5(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com