
 ,其中氧化剂是MnO2,还原剂是HCl.
,其中氧化剂是MnO2,还原剂是HCl. 分析 (1)Ba(OH)2为、Fe2(SO4)3、H2SO4为强电解质,完全电离,用等号;
(2)将NaHSO4溶液与氢氧化钠溶液完全反应本质为氢离子与氢氧根离子反应生成水;
(3)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,Cl元素的化合价升高,以此来分析.
解答 解:(1)Ba(OH)2为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
Fe2(SO4)3为强电解质,完全电离,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-,
H2SO4为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,
故答案为:Ba(OH)2=Ba2++2OH-;Fe2(SO4)3=2Fe3++3SO42-;H2SO4=2H++SO42-;
(2)将NaHSO4溶液与氢氧化钠溶液完全反应本质为氢离子与氢氧根离子反应生成水,离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O;
(3)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mol2e-,用双线桥法表示反应中电子转移的数目 ,
,
故答案为: ;MnO2; HCl.
;MnO2; HCl.
点评 本题考查了电离方程式、离子方程式的书写以及氧化还原反应,把握元素化合价变化及双线桥法表示转移电子的方向和数目为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色石蕊试纸检验NH3 | B. | 品红试纸检验SO2 | ||
| C. | 碘化钾淀粉试纸检验Cl2 | D. | pH试纸检验溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露.”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 | |
| B. | 汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆…能化铁为铜”都是指铜可以采用湿法冶炼 | |
| C. | 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之.”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 | |
| D. | 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| , | 实验操作 | 预期现象 | 结 论 |
| 验证猜想I] | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不变为蓝色 | 不含Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置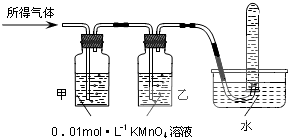 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com