
| A. | 距原子核最近 | B. | 必有成对电子 | C. | 球形对称 | D. | 具有方向性 |
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入过量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 1mol乙烯分子中含有共用电子对数为6NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水达到饱和,可得到HClO分子的数目是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 葡萄糖用于医疗输液是因为它属于强电解质 | |
| C. | Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
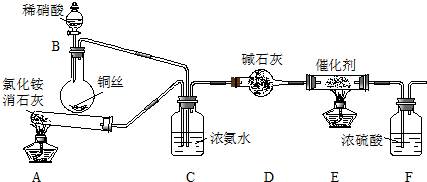
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大 | |
| B. | 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF) | |
| C. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| D. | AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1>K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com