
| A. | C4H8和C5H10 | B. | C3H8和C4H10 | ||
| C. | C2H4O2和C3H6O2 | D. | C6H5OH和C6H5CH2OH |
分析 同结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,同系物必须是同一类物质(含有相同且数量相等的官能团);
解答 解:A.C4H8可能是烯烃,也有可能是环烷烃;C5H10可能是烯烃,也有可能是环烷烃,故两者结构不一定相似,故不一定互为同系物,故A错误;
B.C3H8和C4H10,二者均为烷烃,结构相似,且分子组成上相差6个CH2,所以一定属于同系物,故B正确;
C.C2H4O2可能是羧酸,也有可能是酯;C3H6O2可能是羧酸,也有可能是酯,故两者结构不一定相似,故不一定互为同系物,故C错误;
D.C6H5OH和C6H5CH2OH,前者为苯酚,属于酚类,后者为苯甲醇,属于醇类,二者结构不同,一定不属于同系物,故D错误;
故选B.
点评 本题考查了同系物的判断,题目难度不大,注意明确同系物的概念的判断方法,互为同系物的有机物分子中,如果含有官能团,则含有官能团类型及数目一定完全相同.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | Ca+H2O═Ca(OH)2 | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
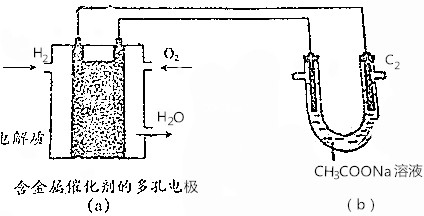
| A. | 若(a)池消耗2.24LH2,则(b)池(C1)极产生0.2mol CO2 | |
| B. | (a)池燃料电池中正极反应式为O2+4e-+4H+═2H2O | |
| C. | 将(b)池电解后的溶液加热蒸干,得到NaOH固体 | |
| D. | (b)池右侧石墨电极(C2)为电解池阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
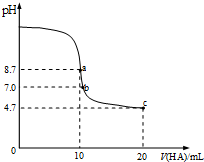
| A. | a点所示溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) | |
| B. | a~b段溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) | |
| C. | pH=7时的溶液中:c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中:c(HA)>c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Va>Vb时:c (CH3COOH)>c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c (CH3COOH)+c (H+)>c (OH-) | |
| C. | Va<Vb时:c (CH3COO-)>c (K+)>c (OH-)>c (H+) | |
| D. | Va与Vb任意比时:c (K+)+c (H+)=c (OH-)+c (CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,2.24LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9gNa2O2晶体中所含的离子总数 | |
| D. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
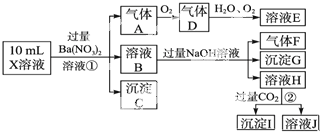
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 | |
| B. | 用排水集气法便可以收集到氯气 | |
| C. | 氯气有漂白性 | |
| D. | 自来水常用氯气来杀菌、消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com