
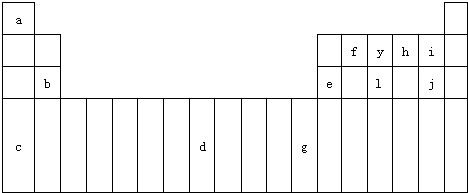
(1)4p轨道半充满的元素。
(2)4s轨道半充满的元素。
解析:(1)4p轨道半充满的元素是p区元素,价电子排布式为4s24p3,是As元素,基态原子的核外电子排布式是1s22s22p63s23p64s24p3。(2)按照基态原子核外电子排布的能级顺序,4s轨道半充满的元素基态原子的核外电子排布式是1s22s22p63s23p64s1,此为K元素。考虑到洪特规则的特例,即4s能级上的一个电子转移到能量稍高的3d能级而使3d能级为半充满或全充满,4s轨道半充满的元素还可以是24Cr和29Cu,它们基态原子的核外电子排布式分别是1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
答案:(1)As 1s22s22p63s23p64s24p3
(2)K 1s22s22p63s23p64s1或Cr 1s22s22p63s23p63d54s1或Cu 1s22s22p63s23p63d104s1


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
 (2013?临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.
(2013?临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.| 320 |
| a3NA |
| 320 |
| a3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省临沂市高三5月高考模拟理综化学试卷(解析版) 题型:填空题
金属铜广泛地应用于电气、机械制造、国防等领域。
(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是 (填元素名称)。
(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
(3)下图是铜的某种氧化物的晶胞示意图。已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为 。

(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。
①SO42-中S原子的杂化方式为 。
②NH3分子内的H—N—H键角 (填“大于”“等于”或“小于”)H2O分子内的H—O—H键角。
③S、N、O三种元素第一电离能由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2012届山西省高二下学期期中考试化学试卷 题型:填空题
(12分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:[来源:学§科§网]
(1)钛有 Ti和
Ti和 Ti两种原子,它们互称为
。Ti元素在元素周期表中的位置是第 周期,第
族;基态原子的电子排布式为
;按电子排布Ti元素在元素周期表分区中属于 区元素
Ti两种原子,它们互称为
。Ti元素在元素周期表中的位置是第 周期,第
族;基态原子的电子排布式为
;按电子排布Ti元素在元素周期表分区中属于 区元素
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是

(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com