
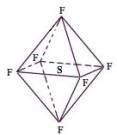
| A.SF6中各原子均达到8电子稳定结构 |
| B.SF6易燃烧生成SO2 |
| C.SF6分子是含有极性键的非极性分子 |
| D.SF6是原子晶体 |
科目:高中化学 来源:不详 题型:单选题
| A.CH4、CS2、BF3 | B.CO2、H2O、NH3 |
| C.C2H4、C2H2、C6H6 | D.CCl4、BeCl2、PH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 |
| B.P4和CH4都是正四面体形分子且键角都为109°28′ |
C.NH4+的电子式为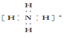 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
| D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
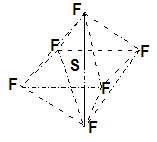
| A.SF6易燃烧生成SO2 |
| B.SF6是极性分子 |
| C.SF6中各原子均达到八电子稳定结构 |
| D.高温条件下,SF6微弱水解生成H2SO4和HF |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.P4和NO2都是共价化合物 |
| B.CCl4和NH3都是以极性键结合的极性分子 |
| C.在CaO和SiO2晶体中,都不存在单个小分子 |
D.甲烷的结构式: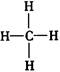 是对称的平面结构,所以是非极性分子 是对称的平面结构,所以是非极性分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO2、NO2+、NO2- | B.CO2、N2O、N3- |
| C.CO32-、NO3-、SO3 | D.N2、CO、CN- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
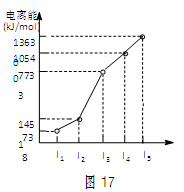
| A.分子中含有氢键 |
| B.分子中既含有极性键又含有非极性键 |
| C.含有4个σ键和1个π键 |
| D.属于非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com