
| A.K+一定存在 |
| B.100 mL溶液中含0.01 mol CO32- |
| C.Cl-一定存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |


科目:高中化学 来源:不详 题型:单选题
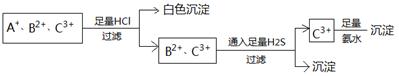
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ |
| C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
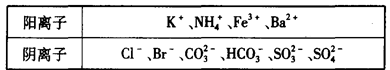

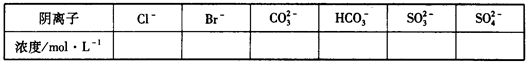
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
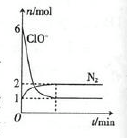
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 |
B.在任何条件下都不能发生Cu+H2SO4=CuSO4+H2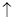 反应 反应 |
| C.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
| D.二氧化氮与水反应的离子方程式是3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com