


科目:高中化学 来源: 题型:
| A、HCN分子的结构式:H-C≡N |
B、二氧化碳的电子式: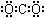 |
C、Cl-的结构示意图为: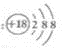 |
| D、乙烯的结构简式为CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键断裂时要吸收能量,形成新化学键时要放出能量 |
| B、化学变化的实质是旧化学键断裂,新化学键形成 |
| C、在化学变化过程中,一定要吸收或放出能量 |
| D、吸收能量或放出能量的过程,一定是化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① |  | Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(NO3)2 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子形成具有相同电子层结构的离子后,原子序数小的离子半径一定大 |
| B、同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
| C、氯化氢的沸点比氟化氢的沸点高 |
| D、从HF、HCI、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用50 mL 12 mol/L的
| ||||||
B、常温下,将1 g
| ||||||
C、向100 mL 3 mol/L的稀硝酸中加入5.6 g
| ||||||
D、常温常压下,0.1 mol
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com