
| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
分析 A、浓硫酸稀释放热;
B、由于无240mL容量瓶且容量瓶只有一条刻度线,故应选用250mL容量瓶,配置出250mL溶液,由于配置稀硫酸的原料是浓硫酸,故选用量筒来量取浓硫酸;
C、求出浓硫酸的物质的量浓度,然后根据稀释定律来计算需要的体积;
D、浓硫酸的稀释不能在容量瓶中进行.
解答 解:A、浓硫酸稀释放热,故为了防止浓硫酸外溅,应将浓硫酸注入水中,故A错误;
B、由于无240mL容量瓶且容量瓶只有一条刻度线,故应选用250mL容量瓶,配置出250mL溶液,由于配置稀硫酸的原料是浓硫酸,故选用量筒来量取浓硫酸,不需要天平,故B错误;
C、浓硫酸的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要的浓硫酸的体积为VmL,根据稀释定律可知:18.4mol/L×VmL=250mL×1.84mol•L-1,解得V=25mL,故C正确;
D、浓硫酸稀释放热,而容量瓶不能受热,故浓硫酸的稀释不能在容量瓶中进行,故D错误.
故选C.
点评 本题考查了配置一定物质的量浓度的溶液的时候的仪器的选择和操作,应注意的是不能在容量瓶中稀释溶液,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H2,N2,SO2 | B. | H2,N2,O2 | C. | HCl,NO2,NH3 | D. | O2,NO2,NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
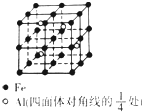 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
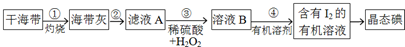
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴加试剂 | 蒸馏水 | 盐酸 | 氯化铵溶液 |
| 现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M=10-4N | C. | N=10-4M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com