
设NA为阿伏加德罗常数,下列说法中正确的是
(A)2NA个二氧化碳分子的质量为44g
(B)2.4g金属镁与足量盐酸完全反应,失电子总数为0.2NA
(C)0.1mol/LNaCl溶液中,Na+与Cl-离子总数为0.2NA
(D)17g氨气中所含原子数为NA
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
0.1mol某种金属元素的单质直接与氯气反应后,质量增加7.1g,则这种元素是
A.Na B.H2 C.Fe D.Cu
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:填空题
(15分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
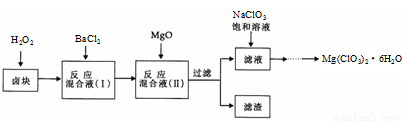
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质②四种化合物的溶解度(S)随温度(T)
变化曲线如图所示。

回答下列问题:
(1)过滤时主要的玻璃仪器有
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是
(3)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)
(4)加入MgO的作用是 ;滤渣的主要成分为
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2: 取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-)
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.固体氯化钠不导电,所以氯化钠是非电解质
B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.CO2的水溶液能导电,所以CO2是电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:选择题
将固体A置于密闭容器中,在一定温度下发生下列反应:
①A(s)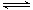 B(g)+C(g);②2C(g)
B(g)+C(g);②2C(g)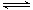 D(g)+E(g)。
D(g)+E(g)。
达到平衡时,c(D)=0.5mol·L-1,c(C)=4mol·L-1,则此温度下反应①的平衡常数为
A.25 B.20 C.16 D.9
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月月考化学试卷(解析版) 题型:选择题
一定量的镁溶于一定量浓度的硝酸的反应中,产生标准状况下的N2O气体11.2L,在所得的溶液中加入足量的氢氧化钠溶液,完全反应后过滤出沉淀,经洗涤,蒸干并充分灼烧,最后得到固体物质的质量为
A.20g B.40g C.58g D.80g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
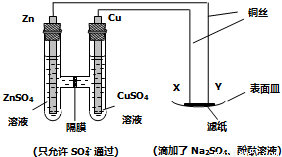
A.Y与滤纸接触处有氧气生成 B.X为正极,发生氧化反应
C.Y为阴极,发生还原反应 D.X与滤纸接触处变红
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:选择题
某温度下,密闭容器中,发生如下可逆反应:2E(g)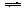 F(g)+xG(g);
F(g)+xG(g);
ΔH<0。若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5a mol/L;若E的起始浓度改为2a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
A.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
B.升高温度时,正反应速率加快、逆反应速率减慢
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol·L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期10月调考理综化学试卷(解析版) 题型:选择题
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g)+ 5O2 (g) 4NO (g)+ 6H2O (g)△H = -9072kJ·mol-1 K=1.1×1026
4NO (g)+ 6H2O (g)△H = -9072kJ·mol-1 K=1.1×1026
② 4NH3 (g)+ 4O2 (g) 2N2O (g)+ 6H2O (g)△H=-1104.9kJ·mol-1 K=4.4×1028
2N2O (g)+ 6H2O (g)△H=-1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g)+ 3O2 (g) 2N2 (g)+ 6H2O (g)△H=-1269.02kJ·mol-1 K=7.1×1034
2N2 (g)+ 6H2O (g)△H=-1269.02kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是
A.增大O2浓度 B.使用合适的催化剂 C.减小压强 D.降低温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com