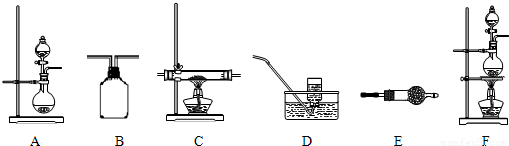
实验室可以通过以下三条途径按不同要求制取氮气:
①加热NaNO
2(一种致癌物质,有毒)与NH
4Cl的混合物浓溶液制取N
2;
②将空气通过灼热的活性铜粉制得较纯净的N
2;
③加热条件下用NH
3还原CuO得纯净的N
2和活性铜粉.
如图所示,给出了按上述途径制取N
2可供选择的几种实验装置:

请回答下列问题:
(1)按途径①制取N
2时,应选用上述装置中的
F
F
(填装置代码)做发生装置.
(2)若只需较纯净的N
2,有同学建议把②和③两条途径协同使用,这样做的好处是
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
.
(3)按途径③制取N
2时,若气流从左到右的顺序所需的上述装置是:A→C→B→D.在A装置中所需要的试剂是
浓氨水
浓氨水
和
生石灰
生石灰
.(写试剂名称)
①甲同学:为通过实验现象验证C处有水产生,必须在C装置前后都连接E装置,其中填充的固体药品按前后顺序分别为
碱石灰(或无水氯化钙)
碱石灰(或无水氯化钙)
、
无水硫酸铜
无水硫酸铜
.(写试剂名称)
②乙同学:实验过程中,发现黑色固体完全变红,质疑此时红色固体可能含Cu
2O.通过查阅资料知:Cu
2O+2H
+=Cu
2++Cu+H
2O.依据信息,请设计实验证明C处的红色固体中是否含有Cu
2O:
取样加入稀硫酸后溶液呈蓝色,即证明含Cu2O
取样加入稀硫酸后溶液呈蓝色,即证明含Cu2O
③丙同学:实验时充分加热,至C装置硬质玻管质量不再减轻为止.实验完毕后,若实验测得收集的N
2体积为aL(已折算为标准状况),硬质玻管质量减轻了bg.则氨分子中氮、氢的原子个数比为(用含a、b的字母的代数式表示)
(此空记3分).
(4)目前工业上用氮气和氢气直接合成氨,氨经一系列反应可制得硝酸.在以上各步反应中,按要求完成化学反应方程式:
①氮元素只发生还原反应
、
②氮元素既发生氧化反应又发生还原反应:
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.




 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案