
| A. | CO2的电子式为: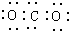 | B. | Cl2的结构式: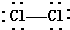 | ||
| C. | 用电子式表示NaCl的形成过程: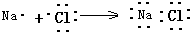 | D. | F-的结构示意图: |
分析 A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
B.结构式,为参与成键的电子对忽略不写;
C.氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成;
D.氟离子核内有9个质子,核外有10个电子.
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,电子式为: ,故A错误;
,故A错误;
B.氯气的结构式为:Cl-Cl,故B错误;
C.氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成,NaCl的形成过程为 ,故C错误;
,故C错误;
D.氟离子核内有9个质子,核外有10个电子,离子结构示意图: ,故D正确;
,故D正确;
故选:D.
点评 本题考查了化学用语的使用,涉及电子式、结构式、结构示意图的书写,有助于学生养成规范使用化学用语的习惯,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | Y的非金属性比Q强,所以HnY的酸性比HnQ强 | |
| B. | ZX2、WX2的熔沸点、硬度相差很大,这是由于它们的化学键类型不同造成的 | |
| C. | W、Q、Y元素的原子半径及其简单离子半径依次减小 | |
| D. | 将足量的X单质通入W的氢化物的水溶液,能得到W的低价氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5amol | B. | 0.1amol | C. | (0.1+a)mol | D. | 2amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),选用适量的NaOH溶液 | |
| B. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随核电荷数的增加而增多,原子半径逐渐增大 | |
| B. | 从上到下,对应单质的颜色随着核电荷数的增加而加深 | |
| C. | 从上到下,随着核电荷数的增加,对应单质与水反应的剧烈程度逐渐增大 | |
| D. | 从上到下,随着核电荷数的增加,对应单质的熔、沸点都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能置换出水中所有的氢,却只能置换出乙醇里羟基中的氢 | |
| B. | 钠都要浮在水面上或乙醇液体表面 | |
| C. | 钠无论与水反应还是与乙醇反应都要放出热量 | |
| D. | 钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| C. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某化合物在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应中转移的电子为n mol,则n一定大于0.15 mol | |
| B. | n(NaCl):n(NaClO):n(NaClO3)可能为7:2:1 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(Na+):n(Cl-) 可能为7:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com