
【题目】25℃时,向20mL0.1molL-1盐酸溶液中逐滴加入等浓度的氨水溶液,溶液中pH与pOH(pOH=一lgc(OH-))的变化关系如图所示。下列说法正确的是

A.b点消耗氨水的体积为20mL
B.PH>7时,溶液中都一定有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.a点和c点所示溶液中水所电离出的c(OH-)分别为10-9molL-1和10-5molL-1
D.ab段所示溶液中相关离子浓度关系可能为:c(NH4+)>c(Cl-)>C(NH3·H2O)
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是( )
A.Q一定是氧化剂
B.当有1 mol O2生成时转移电子4 mol
C.O2一定是氧化产物
D.Na2O2不可能发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25 ℃时各组分含量随pH变化情况如图所示(Cl-) 没有画出。则下列分析不正确的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25 ℃时各组分含量随pH变化情况如图所示(Cl-) 没有画出。则下列分析不正确的是

A.亚氯酸钠在酸性条件下较稳定
B.25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH范围为4--5
D.25 ℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(忽略ClO2和Cl-),则混合溶液中有c(HClO2)+2c(H+)=c(ClO![]() )+2c(OH-)
)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+1/2O2(g)![]() SO3(g)△H=―98.32kJ/mol,下列表述正确的是( )
SO3(g)△H=―98.32kJ/mol,下列表述正确的是( )
A、在容器中充入2molSO2和1molO2充分反应,最终放出的热量等于196.64kJ
B、在容器中当有2molSO2和1molO2发生反应时,放出的热量等于196.64kJ
C、在容器中当有4molSO2和2molO2发生反应时,反应SO2(g)+1/2O2(g)![]() SO3(g)的反应热为-393.28kJ/mol
SO3(g)的反应热为-393.28kJ/mol
D、在容器中当有4molSO2和2molO2发生反应时,反应SO2(g)+1/2O2(g)![]() SO3(g)的反应热为98.32kJ/mol
SO3(g)的反应热为98.32kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅的叙述牛,正确的是( )
A.硅的非金属性比碳强,只有在高温下才能跟氢气起化合反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学
技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从________极流向________极(填“Ag2O”或“Zn”)。
②电极反应式:正极:_____________________,负极:_____________________。
③工作时电池正极区的pH________(填“增大”、“减小”或“不变”)。氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH)
H2+NiO(OH) ![]() Ni(OH)2。
Ni(OH)2。
电池放电时, 负极的电极反应式为_________,正极的电极反应式为________________,正极附近溶液的pH__________(填“增大”,“减小”或者“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I..已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
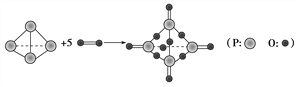
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量为________kJ
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
II.将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶
液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:

(1)该实验表明此反应_______(填“吸收”或“释放”)能量, 通过图示分析可以得出:做该实
验时,环境温度________(填“高于”、“低于”或“等于”)22 ℃。
(2)根据图示计算该NaOH溶液的浓度约是________mol·L-1。
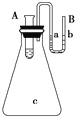
III. 如图所示在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体
②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_____(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子结构示意图为_____________,其中三种主族元素的离子半径从大到小的顺序是___________________(用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是____________________。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com