
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
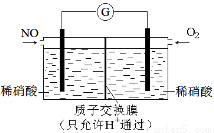
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。

(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

⑴①1(2分)②6NO2+4CO(NH2)2=7N2+8H2O+4CO2(2分)
⑵2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ/mol(2分) ⑶NO-3e-+2H2O=NO3-+4H+(2分)
⑷① c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2) (2分) ② < (2分) ⑸Ⅲ(2分);T1(1分)
【解析】
试题分析:(1)氧化—还原法消除氮氧化物的转化如下:
①标准状况下11.2L氧气的物质的量是0.5mol,则根据反应NO+O3=NO2+O2可知生成11.2 L O2时,消耗NO是0.5mol。氮元素的化合价从+2价升高到+4价,失去2个电子,所以转移电子的物质的量是0.5mol×2=1mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,根据原子守恒可知除了生成氮气外,还有CO2和水生成,所以反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2。
(2)已知:①NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1,②2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1,②2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1,则根据盖斯定律可知②—①×2即可得到NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ/mol。
2SO3(g) △H=-196.6 kJ·mol-1,则根据盖斯定律可知②—①×2即可得到NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ/mol。
(3)原电池中负极失去电子,发生氧化反应,因此NO在负极通入失去电子转化为硝酸根,电极反应式是NO-3e-+2H2O=NO3-+4H+。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知该反应平衡常数表达式为K=c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)。
②根据图像可知在投料比相同的条件下,升高温度CO2的转化率降低,这说明升高温度平衡向逆反应方向进行,所以正反应是放热反应,即该反应的ΔH<0。
(5)随着反应的进行CO逐渐被消耗,含量逐渐降低,当达到平衡状态以后CO的含量最低。由于正反应是放热反应,升高温度平衡向逆反应方向进行,所以CO的含量又逐渐增大。根据图像可知I、Ⅱ、Ⅲ三个容器中CO最高的是Ⅲ,最低的是Ⅱ,这说明温度由T1到T2时CO的含量降低,反应向正反应方向进行,即I一定没有达到平衡状态。温度由T2到T3时CO的含量升高,说明反应向逆反应方向进行,所以Ⅲ一定是平衡状态,而Ⅱ可能是平衡状态,所以一定达到化学平衡状态的是Ⅲ。温度低有利于CO的转化,所以若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是T1。
考点:考查氧化还原反应、盖斯定律、外界条件对平衡状态对影响和计算以及电极反应式等


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:选择题
下列离子方程式或化学方程式与所述事实相符且正确的是
A.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH- = H2O
B.以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.硫酸与氢氧化钡反应的中和热化学反应方程式为:1/2 H2SO4(aq)+1/2 Ba(OH)2(aq) = 1/2 BaSO4(s)+H2O(l) ΔH=-57.3 kJ/mol
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
密闭容器中,发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH<0,下列说法正确的是
CH3OH(g) ΔH<0,下列说法正确的是
A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢
B.若甲醇的生成速率等于一氧化碳的消耗速率,则该反应达到平衡状态
C.升高温度,重新达到平衡时, 增大
增大
D.使用催化剂,反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是

A.金属性:甲>乙>丁
B.原子半径:辛>戊>甲
C.丙与庚的元素原子核外电子数相差13
D.形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A.乙烯的结构简式:CH2CH2
B.S2-的结构示意图:
C.中子数为20的氯原子:
D.羟基的电子式:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX >rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:填空题
(15分)(一)尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵) (l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= -330.0 kJ·mol-1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_______(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。此溶液中各离子浓度由大到小的顺序为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变
B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变
D.单位时间有n个H—O键断裂的同时有n个H—H键断裂
②x应满足的条件是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
25°C时,c(CH3COOH)+c(CH3COO-)=0.1 mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是

A.pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
C.由W点可以求出25°C时CH3COOH的电离常数
D.pH =4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法符合实验事实的有
A.棕红色NO2加压后颜色先变浅后变深
B.向Fe(SCN)3溶液中加入少量KSCN固体,溶液红色变浅
C.把装有NO2气体的烧瓶放入冰水中,气体红棕色变深
D.向新制AgCl悬浊液中滴入Na2S溶液,振荡后沉淀可以由白色变为黑色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com