
| A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中 |
| B.定容时仰视刻度线 |
| C.振荡摇匀后再重新加水至刻度线 |
| D.用水洗涤容量瓶未干燥 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.1 molNa与足量氧气反应转移电子数一定为NA |
| B.标准状况下,22.4 LCHCl3中含有的分子数为NA |
| C.1mol·L-1Na2CO3溶液中含有2NA个Na+ |
| D.常温常压下,71g37Cl2含有NA个37Cl2分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4的摩尔质量是98 |
| B.等物质的量的O2和O3中所含的氧原子数相同 |
| C.等质量的CO与CO2中所含碳原子数相同 |
| D.将98g H2SO4溶解于水配成500mL溶液,所得溶液中硫酸的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.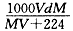 | B.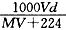 | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
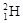 和
和 组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。 2-微粒的结构示意图: 。
2-微粒的结构示意图: 。 MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将0.1 mol氨气充分溶解在1 L水中 |
| B.将10g 1 mol·L-1的硫酸与90 g水混合 |
| C.将8g三氧化硫溶于水并配成1 L溶液 |
| D.将16g CuSO4·5H2O溶于水并配成1 L溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑤>④>③>②>① | B.②>①>③>④>⑤ |
| C.②>③>④>①>⑤ | D.①>②>③>④>⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8 g甲烷含有的共价键数约为NA |
| B.常温常压下,22.4 L二氧化碳原子总数为3NA |
| C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
| D.3.2g硫(结构见图)含S-S键的数目为0.8NA |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com