
(15分)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
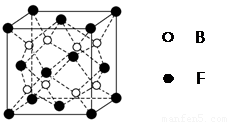
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
(1)2s22p4 (2分) 1s22s22p63s23p6(2分)
(2)Na3AlF6 (2分)
(3)2Al2O3为离子晶体(或者;离子化合物)而AlCl3为分子晶体(或共价化合物)(3分)
(4)CaO晶体中Ca2+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷。(2分)
(5)CaF2(1分)  (3分)
(3分)
【解析】
试题分析:由题干知道A、B是第二周期元素,C、D、E是第三周期元素,F是第四周期元素,同时A原子L层上有2对成对电子,则A为O,则B为F,B、C、D的核外电子排布相同的简单离子,说明C、D的阳离子也是两层,再根据CE、FA为电子数相同的离子晶体,D2A3制取D,则C为Na、D为Al、E为Cl、F为Ca。
(1)O元素的基态原子价电子排布式是2s22p4;Ca2+的电子排布式是1s22s22p63s23p6;
(2)根据元素推断出X为Na3AlF6。
(3)工业制取铝一般不用三氯化铝而用三氧化二铝主要是2Al2O3为离子晶体(或者;离子化合物)而AlCl3为分子晶体(或共价化合物);
(4)CaO晶体大于NaCl晶体的晶格能的主要原因是CaO晶体中Ca2+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷;次要原因是离子半径。
(5)根据Ca2+、F-的所带电荷数可以看出以1:2结合,化学式为CaF2;根据晶胞计算出含有4个Ca2+、8个F-,则 。
。
考点:考查元素周期表结构、元素推断、物质结构、晶体的结构与性质。
点评:本题涉及物质结构中原子、分子、晶体结构、元素周期表、电子排布式、晶格能、晶胞的计算等知识点,知识面广,综合性较强,属于难度较大的一道试题。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com