
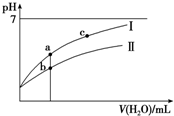
 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
分析 A.酸的电离常数越大,则酸根离子的水解程度越小,则次氯酸根离子的水解程度大于醋酸根离子,故:c(CH3COO-)>c(ClO-);
B.根据强酸制取弱酸判断,反应生成的应该为碳酸氢根离子;
C.$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$的分子、分母同时乘以氢离子浓度可得:$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$=$\frac{K(HR)}{{K}_{W}}$,温度不变,则该比值不变;
D.先根据电离程度大小判断醋酸、次氯酸对应曲线及起始浓度大小,a、b两点加入水的体积相同,则此时酸溶液浓度取决于酸的起始浓度.
解答 解:A.醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;
B.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.在$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$的分子、分母同时乘以氢离子浓度可得:$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$=$\frac{K(HR)}{{K}_{W}}$,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故C正确;
D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D错误;
故选C.
点评 本题考查离子浓度大小比较、弱电解质在溶液中的电离平衡等知识,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键,注意掌握判断离子浓度大小常用方法.


科目:高中化学 来源: 题型:选择题
| A. | 28% | B. | 27.6% | C. | 72.4% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时阳极获得O2 | |
| B. | 电解时阴极获得海绵钛 | |
| C. | 电解时阳极有Cl2放出 | |
| D. | 电解工艺一旦投入实际生产,钛将可与不锈钢和铝合金竞争 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图:
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图: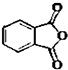 +C4H9OH$\stackrel{H_{2}SO_{4}}{→}$
+C4H9OH$\stackrel{H_{2}SO_{4}}{→}$ 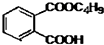 $→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$
$→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$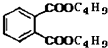
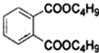 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
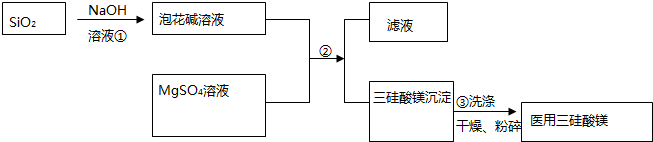
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com