
用下列两种方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________.
(2)除去蒸馏水中溶解的O2常采用________的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是_______________.
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
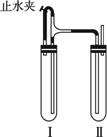
(1)在试管Ⅰ里加入的试剂是________.
(2)在试管Ⅱ里加入的试剂是________.
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________.
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是______________.
|
答案:方法一:(1)稀H2SO4、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2而被氧化 方法二:(1)稀H2SO4、铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入 解析:方法一:(1)Fe2+易水解,要加入稀H2SO4防止其水解;Fe2+易被空气中的O2氧化,要加入Fe粉,将被氧化的Fe3+还原成Fe2+.(2)气体的溶解度是随温度升高而降低的,所以煮沸后的水中溶解的O2变少.方法二:两支试管,试管Ⅱ是开口式,无法用产生的气体将试液压入试管Ⅰ中,所以制取FeSO4应放在试管Ⅰ中,而在试管Ⅱ中盛不含O2的NaOH溶液.当Fe与稀H2SO4放入试管Ⅰ后,产生的H2可从试管Ⅰ内短管处排出试管Ⅰ内空气,经过止水夹通入试管Ⅱ中,再排尽试管Ⅱ内空气.然后关闭止水夹,试管Ⅰ内产生的H2气压将试管Ⅰ内的FeSO4液体通过长导管压入试管Ⅱ内,在此压液过程中,液体都处于H2环境,从而避免了空气中O2的氧化,使得Fe(OH)2能保存更长时间. |


科目:高中化学 来源: 题型:
Ⅰ.实验室通常用二氧化锰和浓盐酸反应制取Cl2。
(1)该反应的离子方程式为________________________________________________。
(2)甲、乙两同学用下列两种方法制取氯气:
甲:用含HCl
乙:用
则二者制得的Cl2(填序号)_______________。
①甲比乙多 ②乙比甲多 ③一样多 ④无法比较
Ⅱ.已知下列反应也可以生成氯气。
①2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2
2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
③2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
其中,适宜于实验室制取Cl2的反应是_____________(填序号,下同),适宜于工业上生产Cl2的反应是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室通常用二氧化锰和浓盐酸反应制取Cl2。
(1)该反应的离子方程式为____________________________________________。
(2)甲、乙两同学用下列两种方法制取氯气:
甲:用含HCl 146 g的浓盐酸与足量二氧化锰反应 乙:用87 g二氧化锰与足量浓盐酸反应
则二者制得的Cl2(填序号)___________。
①甲比乙多 ②乙比甲多 ③一样多 ④无法比较
Ⅱ.已知下列反应也可以生成氯气:
①2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2
2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2![]() 2Cl2+2H2O ③2NaCl+2H2O
2Cl2+2H2O ③2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
其中,适宜于实验室制取Cl2的反应是_____________(填序号,下同),适宜于工业上生产Cl2的反应是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料,除了用于消毒、制备盐酸和漂白剂外,还用于制备有机溶剂和农药。请你通过对氯气性质的研究完成下列问题。
(1)下列有关氯气的叙述中,不正确的是()
A.氯气是一种黄绿色、 有刺激性气味的气体
B.氯气、液氯和氯水是同一物质
C.氯气能溶于水
D.氯气是一种有毒的气体
(2)下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是()
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
(3)实验室用下列两种方法制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。则所得Cl2()
A.①比②多 B.②比①多 C.一样多 D.无法比较
(4)把氯气通入紫色石蕊溶液后,可以观察到的现象是 。请你解释其中的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常情况下,Fe2+及亚铁化合物在空气中易被氧气氧化为Fe3+或铁的化合物。尤其是在碱性条件下,氧化反应进行得十分迅速。用下列两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的溶液与用不含氧气的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时,为防止溶液中Fe2+被氧化,需加入________。
(2)除去蒸馏水中溶解的氧气常采用__________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含氧气的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是___________________________。
方法二:在如图所示装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
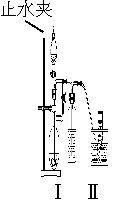
(1)在试管Ⅰ里加入的试剂是____________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com