

分析 粗MnO2(含有较多的MnO2和MnCO3)样品加入硫酸,MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,同时产生二氧化碳,向硫酸锰中加入氯酸钠,反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,将产生的氯气和热的氢氧化钠溶液反应可以得到氯酸钠的溶液,蒸发浓缩结晶可以得到氯酸钠的固体物质.
(1)MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4;
(2)依据得失电子守恒和质量守恒可写出离子方程式;
(3)过滤所需的仪器有烧杯、漏斗、玻璃棒;Cl2通入热的NaOH溶液中有NaClO3和NaCl生成;
(4)根据质量守恒和化学方程式计算5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量.
解答 解:粗MnO2(含有较多的MnO和MnCO3)样品加入硫酸,MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,同时产生二氧化碳,向硫酸锰中加入氯酸钠,反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,将产生的氯气和热的氢氧化钠溶液反应可以得到氯酸钠的溶液,蒸发浓缩结晶可以得到氯酸钠的固体物质.
(1)MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,所以答案是粗MnO2样品中的MnO2和MnCO3转化为可溶性物质,
故答案为:MnO2和MnCO3;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,
故答案为:2、4H2O、5、5、1、8H+;
(3)过滤所需的仪器有烧杯、漏斗、玻璃棒,Cl2通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂,NaClO3属于氧化产物,因此一定有还原产物NaCl,
故答案为:烧杯、漏斗、玻璃棒;NaCl;
(4)由题意知样品中的MnO和MnCO3质量为25.38g-17.4 g=7.98g,0.448LCO2的物质的量为0.02mol,由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物质的量为0.02mol,质量为115g/mol×0.02mol=2.3g,所以MnO的质量为7.98g-2.3g=5.68g,其物质的量为$\frac{5.68g}{71g/mol}$=0.08mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.1mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.04mol,故答案为:0.04.
点评 本题通过MnO2的提纯综合考察了常见的基本实验操作、氧化还原方程式的配平、产物的判断及有关计算,为高频考点,把握流程中发生的化学反应及混合物分离方法为解答的关键,侧重分析能力及推断能力的考查,题目难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1<0 | B. | △H1>△H2 | C. | △H2═△H1+△H3 | D. | △H2>|△H3| |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型如图 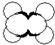 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型如图 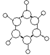 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>O2>N2>H2O | D. | 金刚石>生铁>纯铁>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
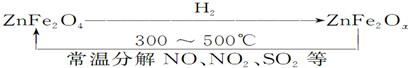
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
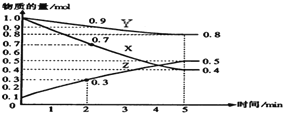
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘原子(12H)中的质子和中子 | B. | CsCl晶胞中的Cs+和Cl- | ||
| C. | Na2O2固体中的阴离子和阳离子 | D. | CO2分子中的σ键和π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
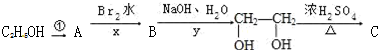
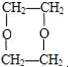 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com