
����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ���CO2Ϊԭ�Ͽɺϳɶ����л��
��1��CO2����������ϩ����֪��2CO2��g��+6H2��g��![]() CH2=CH2��g��+4H2O��g�� ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X=
CH2=CH2��g��+4H2O��g�� ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X=![]() ]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
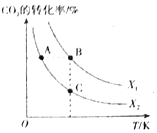
��X1___X2����������������������ͬ����Q___0��
��ͼ��A��B��C�����Ӧ��ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ___��
��2�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH=10����Һ������Һ��c��CO![]() ����c��HCO
����c��HCO![]() ��=___[������K1��H2CO3��=4.4��10-7��K2��H2CO3��=5��10-11]��
��=___[������K1��H2CO3��=4.4��10-7��K2��H2CO3��=5��10-11]��
������5LNa2CO3��Һ��23.3gBaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ___��[��֪��������Ksp��BaSO4��=1��10-7��Ksp��BaCO3��=2.5��10-6].��������Һ������ı仯��
���𰸡��� �� KA��KB=KC 1��2 0.52mol/L
��������
�����¶ȶ�ƽ���Ӱ�죬��ѧƽ�ⳣ��ֻ���¶�Ӱ�죻���ݵ���ƽ�ⳣ�����ܽ�ƽ�ⳣ����ʽ���㼴�ɡ�
��1������ͬ�����£�����������Ũ�ȣ�CO2��ת��������X1��X2����ͼ��֪���¶����ߺ�CO2��ת���ʽ��ͣ�˵��ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��Q��0��
�ڻ�ѧƽ�ⳣ�����¶��йأ��¶���ȣ�K��ȣ���ӦΪ���ȷ�Ӧ���¶Ƚϵ�ʱK�ϴ�KA��KB��KC��
��2������ij�β���õ�pH��10����Һ��c��H+����10-10mol/L��K2=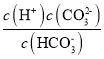 ������Һ��c��
������Һ��c��![]() ����c��
����c��![]() ����K2��c��H+����(5��10-11):(10-10)=1:2��
����K2��c��H+����(5��10-11):(10-10)=1:2��
��23.3gBaSO4���ʵ���n��BaSO4����![]() ��0.1mol����0.1mol���ᱵ�ܽ���5L��Һ�У���������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ������5L��Һ��c��
��0.1mol����0.1mol���ᱵ�ܽ���5L��Һ�У���������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ������5L��Һ��c��![]() ��=0.02mol/L����ʱ��Һ��c��
��=0.02mol/L����ʱ��Һ��c��![]() ��=��x-0.02��mol/L����BaSO4+
��=��x-0.02��mol/L����BaSO4+![]() BaCO3+
BaCO3+![]() ��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K=
��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K= 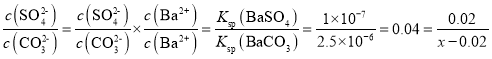 �����x=0.52��
�����x=0.52��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PHB��һ����֬���л���K��һ�ֿ�����ҩ����ǵĺϳ�·�����£�
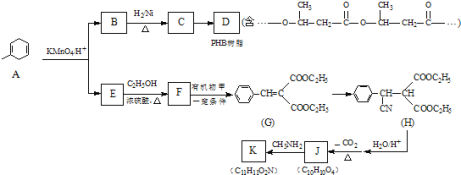
��֪��R��R����R����������
��RCN��H2O/H+RCOOH
��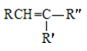
![]() RCOOH+
RCOOH+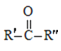
��
![]()
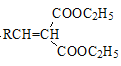 +H2O
+H2O
(1)B��C�ķ�Ӧ������_____��
(2)д��һ��������C��D�Ļ�ѧ����ʽ_____����
(3)�л���Ľṹ��ʽΪ_____��
(4)д��E��F�Ļ�ѧ����ʽ_____��
(5)��֪1mol J�����2mol NaHCO3��Ӧ��K���ӽṹ�к���һ����Ԫ����һ����Ԫ����д��һ��������J��K�Ļ�ѧ����ʽ��_____��
(6)S��A��һ��ͬ���칹�壬������û�л�״�ṹ��S�ĺ˴Ź��������������壬�����֮��Ϊ6��3��1����S�Ľṹ��ʽΪ(д��һ�ּ���)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̵�ص����С�������������dz��õ�һ�ε�ء��õ�ط�Ӧԭ����ͼ��ʾ�����е������LiClO4�����ڻ���л��ܼ��У���������ӣ�Li����ͨ�������Ǩ����������̾����У�����LiMnO2��
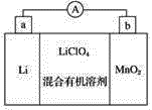
�ش��������⣺
��1�����·�ĵ�����������________������________��������ĸ����
��2����ص�������ӦʽΪ___________��
��3���Ƿ����ˮ�������еĻ���л��ܼ�________����������������������ԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ȡ�������(K2FeO4)��������ȡ�������ƣ�Ȼ���ڵ����£�������������Һ�м���KOH�����;Ϳ�������������ء�ʪ���Ʊ�Na2FeO4����Ҫ��ӦΪ��2Fe(OH)3+3ClO��+4OH����2FeO42��+3Cl��+5H2O���ɷ���Na2FeO4����Ҫ��ӦΪ��2FeSO4+6Na2O2��2Na2FeO4+2Na2SO4+O2���������й�˵������ȷ����(����)
A.ʪ���ɷ��Ʊ��У�����1molNa2FeO4ת�Ƶ�����Ŀ��ͬ
B.��������ڵ����µ��ܽ�ȱȸ������Ƶ��ܽ��С
C.�ɷ��Ʊ�����Ҫ��Ӧ��Na2O2��������
D.K2FeO4����ˮʱ������ɱ�����������ɵ�Fe(OH)3���廹������ˮ�е���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2AΪ��Ԫ����,20��ʱ������һ��c(H2A)+c(HA-)+c(A2-)=0.100mol/L��H2A��NaOH�����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������˵���������

A. Ka2(H2A)��������Ϊ10-5
B. NaHA��Һ��:c(H+)>c(OH-)
C. M����ˮ�������c(H+)>N����ˮ�������c(H+)
D. pH=7����Һ��:c(Na+)>2c(A2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ס��ҡ�������Ϊ���������A��BΪ���ʣ��ת����ϵ��ͼ�����м�����Ȼ������Ҫ�ɷ֡��ش��������⣺
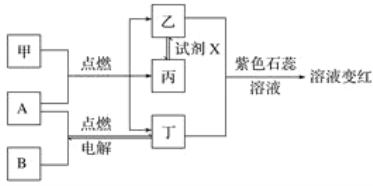
��1�������ʵ����ƣ�______�������ʵĻ�ѧʽ��_________________________________________��
��2�����黯�����ҵĻ�ѧ����ʽ��___________________________________________________��
��3���Լ�X���ܵĻ�ѧʽ��________��________(Ҫ����ѡ�������ͬ)��
��4��ͨ������������ȼ�ϳ��ȼ�յ�����֮һ��______________________________��
��5��ȡ�����Һ���Թ��м��ȣ��۲쵽��������_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��ľ�ļӹ���ҽҩ�ȷ�������Ҫ��;���״�ֱ�������ǹ�ҵ�Ϻϳɼ�ȩ���·������Ʊ������漰����Ҫ��Ӧ���£�
��Ӧ��CH3OH��g��![]() HCHO��g��+H2��g�� ��H1=+85.2kJ/mol
HCHO��g��+H2��g�� ��H1=+85.2kJ/mol
��Ӧ��CH3OH��g��+12O2��g��![]() HCHO��g��+H2O��g�� ��H2
HCHO��g��+H2O��g�� ��H2
��Ӧ��2H2��g��+O2��g��![]() 2H2O��g�� ��H3=483.6kJ/mol
2H2O��g�� ��H3=483.6kJ/mol
��1�����㷴Ӧ��ķ�Ӧ����H2=___��
��2��750K�£��ں����ܱ������У�������ӦCH3OH��g��=sHCHO��g��+H2��g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊa����ƽ��ʱ����ѹǿPƽ=___���ú�P0��a��ʽ�ӱ�ʾ������P0=101kPa�����a=50.0%�����㷴Ӧƽ�ⳣ��Kp=___kPa����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������ͼװ�ô�����ʯȼ�Ͽ��ɡ��ӹ����̲�����H2S��������֪�����е������缫��Ϊ���Ե缫������˵������ȷ����
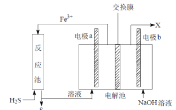
A.������ĤΪ���ӽ���Ĥ����NaOH��Һ��Ũ�������Ҫ���ڸ���
B.������ĤΪ�����ӽ���Ĥ��b �缫����������ɫ����
C.�缫 a Ϊ����
D.��Ӧ���д���H2S�ķ�Ӧ��H2S +2Fe3+ = 2Fe2+ +S��+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��HΪ��ѧ��ѧ�г��������ʣ�ת����ϵ����ͼ��ʾ��������������������������������ʣ�AΪҽѧ������θ������һ��ҩ����GΪ����ɫ���壬C��ͨ��״����Ϊ��ɫҺ�塣
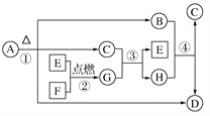
��ش��������⣺
(1)G�Ļ�ѧʽΪ________��ÿ����1��Gת�Ƶ���________����
(2)��Ӧ�٢ڢۢ���________(�����)����������ԭ��Ӧ��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ��
A��B��C��D��___________________________________��
F��C��__________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com