
分析 (1)发生反应:2Na+2H2O═2NaOH+H2↑,根据n=$\frac{m}{M}$计算Na、水的物质的量,根据方程式计算NaOH物质的量、参加反应水的物质的量,进而计算溶液中水的物质的量,Na+与H2O分子的个数比等于其物质的量之比;
(2)由2Na+2H2O=2NaOH+H2↑,0.1molNa与NaOH溶于水,溶液中NaOH的物质的量都是0.1mol,而Na与水反应生成氢气,故Na与水反应所得溶液的质量小于NaOH溶于水形成的溶液质量;
由反应:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,可知0.1mol的氧化钠、过氧化钠溶于水,溶液中NaOH都是0.2mol,由差量法可知,过氧化钠溶于水相当于氧化钠溶于水,二者所得溶液质量相等,结合质量分数=$\frac{溶质质量}{溶液质量}$×100%判断;
(3)钠和稀盐酸、水都反应,根据Na计算生成氢气物质的量;Mg、Al不与水反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.4molMg、Al完全反应需要盐酸的物质的量分别是0.8mol、1.2mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,根据HCl生成氢气物质的量,相同条件下气体体积之比等于物质的量之比.
(4)发生反应:2Na2O2+2CO2=2Na2CO3+O2,导致混合气体物质的量减小,设N2、O2、CO2的物质的量分别为2mol、3mol、4mol,则反应后气体总物质的量为9mol×$\frac{8}{9}$=8mol,根据差量法计算反应二氧化碳物质的量、生成氧气物质的量,进而计算反应后混合气体中N2、O2、CO2物质的量之比;
(5)所含元素化合价降低的反应物为氧化剂,氧化剂发生还原反应得到还原产物,所含元素化合价升高的反应物为还原剂,还原剂发生氧化反应得到氧化产物;
反应中Cu元素化合价由CuSO4中+2价降低为Cu2S中+1价,FeS2中S元素的化合价由-1价分别升高到+6价和降低到-2价.
解答 解:(1)n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,n(H2O)=$\frac{73.8g}{18g/mol}$=4.1mol
2Na+2H2O═2NaOH+H2↑
2 2 2
0.1mol 0.1mol 0.1mol
n(Na+)=n(NaOH)=0.1mol,反应溶液中水的物质的量为4.1mol-0.1mol=4mol,
所得溶液中Na+与H2O分子的个数比是0.1mol:4mol=1:40,
故答案为:1:40;
(2)由2Na+2H2O=2NaOH+H2↑,0.1molNa与NaOH溶于水,溶液中NaOH的物质的量都是0.1mol,而Na与水反应生成氢气,故Na与水反应所得溶液的质量小于NaOH溶于水形成的溶液质量,故溶液质量分数:丁<甲;
由反应:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,可知0.1mol的氧化钠、过氧化钠溶于水,溶液中NaOH都是0.2mol,由差量法可知,过氧化钠溶于水相当于氧化钠溶于水,二者所得溶液质量相等,二者溶液质量分数:乙=丙,
乙所得NaOH为甲中的2倍,而乙所得溶液质量=100g+0.1mol×62g/mol=106.2g,由方程式可知,甲中生成氢气的物质的量=0.1mol×$\frac{1}{2}$=0.05mol,甲中所得溶液的质量=100g+0.1mol×23g/mol-0.05mol×2g/mol=102.2g,故乙所得溶液质量小于甲所得溶液的2倍,故溶液质量分数:甲<乙,
故质量分数:丁<甲<乙=丙,
故答案为:丁<甲<乙=丙;
(3)钠和稀盐酸、水都反应,根据2Na~H2↑可知,0.4molNa完全反应,生成氢气的物质的量=0.4mol×$\frac{1}{2}$=0.2mol,
Mg、Al不与水反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.4molMg、Al完全反应需要盐酸的物质的量分别是0.8mol、1.2mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,所以二者与酸反应生成氢气的量相等,由氢原子守恒,可知生成氢气的量=$\frac{0.1mol}{2}$=0.05mol,所以同温同压下产生的气体的物质的量之比=0.2mol:0.05mol:0.05mol=4:1:1,
故答案为:4:1:1;
(4)设N2、O2、CO2的物质的量分别为2mol、3mol、4mol,则反应后气体总物质的量为9mol×$\frac{8}{9}$=8mol,
2Na2O2+2CO2=2Na2CO3+O2 物质的量减小
2 1 1
2mol 1mol mol-8mol=1mol
反应后混合气体中N2、O2、CO2物质的量之比=2mol:(3+1)mol:(4-2)mol=1:2:1,
故答案为:1:2:1;
(5)在反应中14CuSO4+5FeS2+l2H2O═7Cu2S+5FeSO4+12H2SO4,Cu元素化合价由CuSO4中+2价降低为Cu2S中+1价,Cu元素化合价降低,被还原,CuSO4为氧化剂,Cu2S是还原产物,FeS2中S元素的化合价由-1价分别升高到+6价和降低到-2价,则FeS2既为氧化剂又为还原剂,Cu2S是还原产物,
5molFeS2和14molCuSO4正好反应,反应过程中Cu得电子:14×1 mol=14 mol,S得电子:7×1 mol=7 mol,S失电子:3×7 mol=21 mol,反应中电子转移了21 mol;1.4mol硫酸铜反应,可以氧化硫元素的物质的量为:$\frac{1.4mol×1}{6-(-1)}$=0.2mol,
故答案为:FeS2;还原产物;21;0.2.
点评 本题属于拼合型题目,涉及化学方程式计算、过量计算、溶液浓度计算、氧化还原反应基本概念与计算等,侧重考查学生分析计算能力,难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
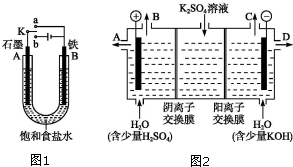 某课外活动小组用如图装置进行实验,试回答下列问题:
某课外活动小组用如图装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |
| 石墨烯:从石墨中分离出来,是最薄、最坚硬的物质 | 石墨块:平面网状结构的全碳分子,具有优良的化学稳定性 | 纳米碳管:具有优良的场发射性能,制作阴极显像管、储氢材料 |
| A. | 石墨烯具有良好的导电性 | |
| B. | 上述三种物质与金刚石互为同素异形体 | |
| C. | 石墨炔孔径略大于H2分子的直径,可作H2的提纯薄膜 | |
| D. | 上述三种物质与浓硫酸都能发生反应,但反应产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 一定有Ag+ | D. | 可能有SO42-,也可能有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上炼铁的原料是赤铁矿 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 | |
| D. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的结构类似于金刚石 | |
| B. | 硅是良好的半导体材料 | |
| C. | 硅的性质较稳定,在自然界中存在游离态 | |
| D. | 可以用焦炭还原二氧化硅生成硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2→O2 | B. | FeCl2→FeCl3 | C. | KClO3→O2 | D. | Al2O3→AlO${\;}_{2}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com