
一定温度下,在容积为VL的密闭容器中进行aN(g) bM(g)的化学反应,M、N物质的量随时间的变化曲线如下图所示:
bM(g)的化学反应,M、N物质的量随时间的变化曲线如下图所示:
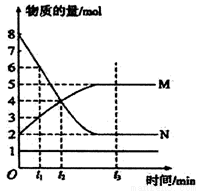
(1)此反应的化学方程式中a/b=__________。
(2)tl到t2时刻,以M 的浓度变化表示的化学反应速率为__________。
(3)此反应达到平衡时,反应物的转化率为___________。
科目:高中化学 来源:2017届山东省高三上学期第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.常温常压下,8gO2含有4NA个电子
B.1L0.1 mol/L的氨水中有NA个NH4+
C.标准状况下,22.4L盐酸含有NA个HCl分子
D.1molNa被完全氧化生成Na2O2,失去个2NA电子
查看答案和解析>>
科目:高中化学 来源:2017届江西省等六校高三上学期第一次联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是 ( )
A.用过量氨水吸收工业尾气中的SO2: NH3·H2O+SO2=NH4++HSO3-
B.氯化钠固体与浓硫酸混合加热:2H++H2SO4+2Cl- SO2↑+Cl2↑+2H2O
SO2↑+Cl2↑+2H2O
C.氧化亚铁溶于稀硝酸:3 Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D. 0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH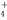 +Al3++2SO
+Al3++2SO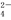 +2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期初调研化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01 mol·L-1Ba(OH)2溶液中:Al3+、NH4+ 、NO、HCO
B.0.1 mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO-
C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I-
D.由水电离产生的c(H+)=1×10-13mol·L-1的溶液中:Na+、Ba2+、NO、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期初调研化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B.石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.电解饱和NaCl饱和溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.21周考化学卷(解析版) 题型:填空题
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
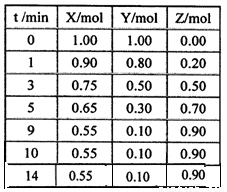
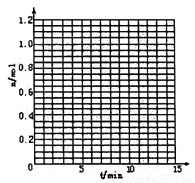
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是_____________;
(3)列式计算该反应在0~3min时间内产物Z的平均反应速率:___________;
(4)该反应达到平衡时反应物X的转化率α等于___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.21周考化学卷(解析版) 题型:选择题
某反应A+B 2C达到平衡时,增大压强,C的量减少,则下列结论符合该平衡的是()
2C达到平衡时,增大压强,C的量减少,则下列结论符合该平衡的是()
A.A、B、C都是气体 B.A、B、C都是固体
C.B、C是气体,A是固体 D.A、C是气体,B是固体
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:填空题
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,HCN中C的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=_________,联氨和N2O4可作为火箭推进剂的主要原因为__________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨在水中第一步电离反应的平衡常数值为______________(已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 _。联氨可用于处理高压锅炉水中的氧气,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 _。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:填空题
酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式_______________。
(2)取300mL0.3mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。解释产生这两个过程的原因______________________。
(4)NaClO具有很强的氧化性,可以和Fe(NO3)3制取具有高效净水功能的Na2FeO4,写出相关的方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com