
����Ŀ���������ǵ���������ˮƽ�IJ�����ߺ�ҵ�����ٷ�չ��������ȾҲ������أ��������ж�������Ҫ����SO2��CO��NOx������ȵȡ�
��1���ڸ�����ִ��������£�CH4��ʹSO2ת��ΪS��ͬʱ����CO2��ˮ����֪CH4��S��ȼ������H�ֱ�Ϊ-890 kJ/mol��-297kJ/mol����CH4��SO2��Ӧ���Ȼ�ѧ����ʽΪ_________________________________________��
��2����20 L���ܱ������а����ʵ���֮��1��2����CO��H2��������Ӧ��CO(g)��2H2(g)![]() CH3OH(g) ��H�����CO��ת�������¶ȼ���ͬѹǿ�ı仯��ͼ��ʾ��P2��195 ��ʱn(H2)��ʱ��ı仯��������ʾ��
CH3OH(g) ��H�����CO��ת�������¶ȼ���ͬѹǿ�ı仯��ͼ��ʾ��P2��195 ��ʱn(H2)��ʱ��ı仯��������ʾ��
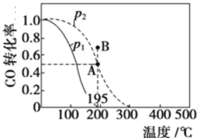
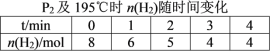
��P2��195��������B��ʱ��v(��)_____v(��)���>������<����=������
�ڸ÷�Ӧ����H_________0���>������<����=������ԭ����______________________________��
����0��2 min��ƽ����Ӧ����v(CH3OH)��______________________������ֵ��С����ʽ��ʾ��
����P2��195 ��ʱ���÷�Ӧ��ƽ�ⳣ��Kp=__________ (��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������ú�P2�ķ�ʽ��ʾ)��
��3��ij������̼����ȼ�ϵ����Li2CO3��K2CO3Ϊ����ʡ���CH4Ϊȼ��ʱ���õ�ع���ԭ����ͼ��ʾ��
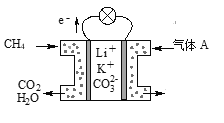
������A�г���O2�⣬һ�������е�������________��
�ڸõ�صĸ�����ӦʽΪ__________________________��
���𰸡�CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ��H= -296 kJ/mol < < ������������ʱ�������¶ȣ�һ����̼��ת���ʽ��ͣ�ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ����Ϊ���ȣ�����Ӧ������� 0.0375 mol��L��1 min��1 9/P22 CO2�������̼ CH4-8e-+4CO32-=5CO2+2H2O
��������
��1��CH4��SO2��Ӧ����S��CO2��ˮ������CH4��S��ȼ���Ȼ�ѧ����ʽ��������Ӧ�ġ�H ��
��2����A����ƽ��״̬��B��ת���ʴ���A�㣬Ӧ�����淴Ӧ�����ƶ�������B��v��������v���棩��
�������¶�ʱ��CO��ת���ʽ��ͣ�ƽ�������ƶ���������Ϊ���ȷ�Ӧ���ݴ˷�����
��Kp=P(CH3OH)/P2(H2)��P(CO)���г�����ʽ����ʾ��P(CH3OH)��P(H2)��P(CO)���������ʽ���ɣ�
��3����ԭ���Ϊ����ȼ�ϵ����ͨ��ȼ�ϵĵ缫Ϊ������ͨ���������ĵ缫Ϊ�������ֱ�д����������Ӧʽ���������������з�����
��1��CH4��S��ȼ������H�ֱ�Ϊ-890 kJ/mol��-297kJ/mol����CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) ��H= -890 kJ/mol ����S(s)+ O2(g)=SO2(g) ��H= -297kJ/mol ������-2���ڵã�CH4 (g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ��H= -296 kJ/mol��
��2���ٸ��ݱ�������֪��ƽ��ʱ����ת����Ϊ50%�������淴Ӧ�г�ʼ��Ӧ�����ʵ���֮�ȵ����������֮��ʱ���䷴Ӧ��ת������ȣ����Ը��¶Ⱥ�ѹǿ��CO��ת����Ϊ50%������ͼ֪��A����ƽ��״̬��B��ת���ʴ���A�㣬�÷�Ӧ�ڸ��¶Ⱥ�ѹǿ�´ﵽƽ��״̬��Ӧ�����淴Ӧ�����ƶ�������B��v��������v���棩��
�������¶�ʱ��CO��ת���ʽ��ͣ�ƽ�������ƶ���������Ϊ���ȷ�Ӧ���ʸ÷�Ӧ����H<0��
����0��2 min��ƽ����Ӧ����v(H2)����n/v/��t=3mol/20L/2min=0.075mol��L��1 min��1 ��v(CH3OH)=1/2 v(H2)=0.0375 mol��L��1 min��1��
�� CO(g)��2H2(g)![]() CH3OH(g)
CH3OH(g)
n0 4mol 8mol 0mol
��n 2mol 4mol 2mol
nƽ 2mol 4mol 2mol
������ʽ��֪����Ӧǰ�����ʵ���֮��=3:2����ƽ��ʱѹǿP=2/3P2����P(CH3OH)=2/3P2��2/8=1/6P2��P(H2)=1/3P2��P(CO)= 1/6P2��Kp=P(CH3OH)/P2(H2)��P(CO)= 1/6P2/[(1/3P2)2��1/6P2]=9/P22;
��3����ԭ���Ϊ����ȼ�ϵ�أ�����ͼ���е�������֪����ߵ缫Ϊ�������ұߵ缫Ϊ������������ӦʽΪCH4+4CO32--8e-=5CO2+2H2O��������ӦʽΪO2+2CO2+4e-�T2CO32-����������A�г���O2�⣬һ�������е������Ƕ�����̼��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2(g) + I2(g) ![]() 2HI(g) ��H < 0������ͬ�ݻ����ܷ��������������м���H2��I2��0.1mol �����м���0.1mol H2��0.2mol I2����ͬ�¶��·ֱ�ﵽƽ�⡣����˵������ȷ����(�� )
2HI(g) ��H < 0������ͬ�ݻ����ܷ��������������м���H2��I2��0.1mol �����м���0.1mol H2��0.2mol I2����ͬ�¶��·ֱ�ﵽƽ�⡣����˵������ȷ����(�� )
A. ���з�Ӧ���ʱȼ��з�Ӧ���ʿ�
B. ƽ��ʱ�ס����������л����������ʵ���֮��Ϊ2:3
C. ��ƽ��ʱ����H2��ת����Ϊ40%��������H2��ת���ʴ���40%
D. ƽ����������ټ���0.1mol H2�������µ�ƽ��ʱ��������H2�İٷֺ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ���ǣ� ��

A.a��b������ʱ����Ƭ�ϻ��н���ͭ����
B.a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2��+2e-= Cu
C.����a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ
D.a��b�õ�������ʱ��SO42-��ͭ�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ý����Ҫ�Ĵ�����CO��������ý���õ�����ʧȥ�����ԣ�Fe+5CO=Fe(CO)5����ȥCO�Ļ�ѧ��Ӧ����ʽΪ��[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3��
��ش��������⣺
��1��C��N��O�ĵ縺���ɴ�С��˳��Ϊ_________________����̬Feԭ�ӵļ۵����Ų�ͼΪ________________��
��2��Fe(CO)5�����ʻ�����������Ϊ��ɫ��״Һ�壬��Fe(CO)5�ľ���������__________����CO��Ϊ�ȵ�����ķ��ӵĵ���ʽΪ_________________��
��3�������[Cu(NH3)2]OOCCH3��̼ԭ�ӵ��ӻ�������_____________���������ṩ�¶Ե��ӵ�ԭ����___________________________________��
��4����[Cu(NH3)2]OOCCH3��ȥCO�ķ�Ӧ�У��϶���_______________�γɡ�
a�����Ӽ� b����λ�� c���Ǽ��Լ� d������
��5��NaAlH4����ľ�����ͼ ����Na�������ҵȾ��AlH4����___________����NaAlH4������ܶ�Ϊ_________g��cm��3���ú�a�Ĵ���ʽ��ʾ����
����Na�������ҵȾ��AlH4����___________����NaAlH4������ܶ�Ϊ_________g��cm��3���ú�a�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 L�ܱ������г���6 mol A�����5 mol B���壬��һ�������·�����Ӧ��3A(g)��B(g)![]() 2C(g)��xD(g)��5 s�ﵽƽ�⡣�ﵽƽ��ʱ��������2 mol C�����ⶨD��Ũ��Ϊ0.5 mol��L��1�������ж���ȷ����( )
2C(g)��xD(g)��5 s�ﵽƽ�⡣�ﵽƽ��ʱ��������2 mol C�����ⶨD��Ũ��Ϊ0.5 mol��L��1�������ж���ȷ����( )
A. x��1B. B��ת����Ϊ20%
C. ƽ��ʱA��Ũ��Ϊ1.50 mol��L��1D. B��ƽ����Ӧ����Ϊ0.2 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ա���HCHO(��ȩ����O2���ǻ���ʯ��HAP)���������H2O�����̣�������ʾ��ͼ���£�ͼ��ֻ������ HAP�IJ��ֽṹ����
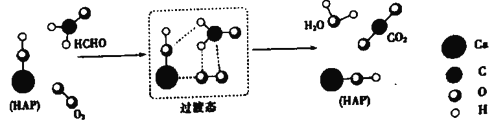
����˵������ȷ����
A. HAP�����HCHO��O2�ķ�Ӧ����
B. HCHO�ڷ�Ӧ�����У���C-H����������
C. ����ͼʾ��Ϣ��CO2�����е���ԭ��ȫ������O2
D. �÷�Ӧ�ɱ�ʾΪ��HCHO+O2![]() CO2+H2O
CO2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�ص����ʻ�ԭ�ӽṹ |
X | �����������Ǵ�����������3�� |
Y | �����µ�����˫ԭ�ӷ��ӣ����⻯���ˮ��Һ�Լ��� |
Z | ��������Ԫ�صļ������а뾶��С |
(1)Ԫ��X��һ�ֵ����������г�������ˮ�������������õ��ʵĻ�ѧʽ��________��Ԫ��Z�����ӽṹʾ��ͼΪ________��
(2)Ԫ��Y����Ԫ���γ�һ������YH![]() ����д�������ӵ���ʽ __________________��
����д�������ӵ���ʽ __________________��
(3)д��ZԪ������������Ӧ��ˮ������NaOH��Һ��Ӧ�����ӷ���ʽ��
___________________________________��
(4)Ԫ��X��Ԫ��Y��ȣ��ǽ����Խ�ǿ����________(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����________��
a��Y���⻯����ڴ�X2��ȼ������X���⻯���Y2
b��X�ĵ��ʱ�Y�ĵ��ʸ�������H2����
c��X��Y�γɵĻ�������YԪ�س�����̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ͺ����IJ����ǣ��乤��ԭ����ͼ��ʾ(��ǿ������Һ���������Һ)������˵���в���ȷ����
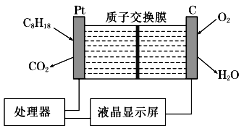
A. ʯī�缫��������������ԭ��Ӧ
B. ���缫�ĵ缫��ӦʽΪC8H18��16H2O��50e��=8CO2����50 H��
C. H�������ӽ���Ĥ������Ҳ�Ǩ��
D. ÿ����5.6 L O2����·��ͨ��1 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2(g)+O2(g)=2NO(g)�������仯��ͼ��ʾ����֪���Ͽ�1mol N2(g)�л�ѧ��������946kJ�������Ͽ�1mol O2(g)�л�ѧ��������498kJ������

����˵����ȷ����
A. N2(g)+O2(g)=2NO(g) ��H��-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) ��H��+90![]()
C. �Ͽ�1mol NO(g)�л�ѧ����Ҫ����632kJ����
D. �γ�1 mol NO(g)�л�ѧ�����ͷ�90kJ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com