
分析 利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;根据目标方程改写分方程,然后求出反应热.
解答 解:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=aKJ•mol-1 ①CO(g)+H2O(g)═CO2(g)+H2(g)△H2=bKJ•mol-1 ②2CO(g)+O2(g)═2CO2(g)△H3=cKJ•mol-1 ③反应2CO2(g)+CH4(g)═2CO(g)+2H2(g)为①+②×2-③×2得到,故此反应的△H=(a+2b-2c)kJ/mol,
故答案为:(a+2b-2c).
点评 本题考查了盖斯定律在计算中的应用,题目难度不大,注意把握分方程式与目标方程式的关系,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
在pH=1溶液中能大量共存的是
A.Na+、SO42-、Ba2+、Cl- B.Na+、K+、CH3CHOO-、NO3-
C.H+、Cu2+、OH-、CO3- D.Na+、K+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
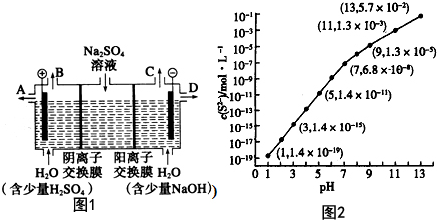
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
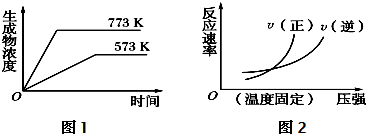
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
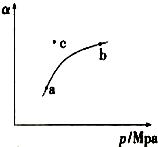 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com