
| A、分子里含有苯环的化合物 |
| B、分子组成符合CnH2n-6 通式的一类有机物 |
| C、分子里含有一个或多个苯环的烃 |
| D、苯和苯的同系物的总称 |
科目:高中化学 来源: 题型:
| A、体系压强不再发生变化 |
| B、各组分的物质的量浓度不再改变 |
| C、各组分的质量分数不再改变 |
| D、反应速率vA:vB:vC:vD=m:m:p:q |
查看答案和解析>>
科目:高中化学 来源: 题型:
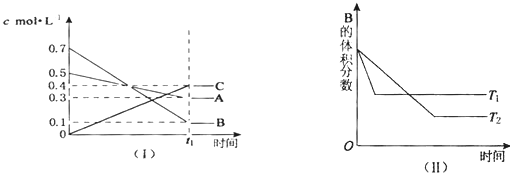
| A、该反应的化学方程式为:2A(g)+7B(g)?4C(g);△H<0 |
| B、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C、在(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 二氧化碳中混有的少量一氧化碳 | 通入适量氧气点燃 | 一氧化碳会燃烧成二氧化碳 |
| B. | 除去鸡蛋清胶体中混的杂质NaCl | 过滤 | 鸡蛋清胶体不能通过滤纸 |
| C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D. | 除去BaSO4粉末中的BaCO3 | 盐酸溶解过滤洗涤 | 盐酸可溶BaCO3,不溶BaSO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质受热能发生变性,故加热能杀死流感病毒 |
| B、食品添加剂均对人体健康有害,故应禁止使用 |
| C、维生素C因具有酸性,故可做抗氧化剂 |
| D、明矾因有净水作用,故可淡化海水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
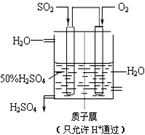 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
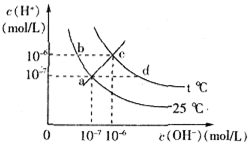
| A、c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B、将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C、t℃>25℃ |
| D、ac线上的任意一点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
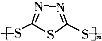 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(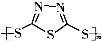 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(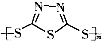 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 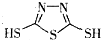 转化为 转化为 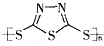 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com