
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
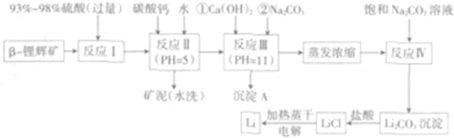
分析 β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,加入过量浓硫酸溶解β-锂辉矿,加入碳酸钙除去过量的硫酸调节溶液PH=5,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂;
(1)根据元素的化合价将Li、Al、Si写成氧化物形式,中间用•连接即可;
(2)根据工艺流程可知,加入碳酸钙目的是除去硫酸,调节溶液pH,除去铁离子、铝离子;
(3)反应Ⅲ要除去镁离子,加入过量氢氧化钙后生成氢氧化镁沉淀,然后用碳酸钠除去过量的钙离子杂质,所以沉淀为氢氧化镁、碳酸钙,据此写出反应的离子方程式;
(4)分离出不溶物方法为过滤;根据表中数据可知,Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)根据蒸干LiCl溶液时,LiCl有少量水解生成LiOH,氢氧化锂部分分解生成氧化锂,电解时会生成氢气.
解答 解:(1)将硅酸盐改为氧化物形式的方法为:依次将各元素写成氧化物形式,中间用“•”连接,同时要注意氧化物先后顺序,用氧化物形式表示LiAlSi2O6的组成为Li2O•Al2O3•4SiO2,
故答案为:Li2O•Al2O3•4SiO2;
(2)由(1)改写可知,β-锂辉矿在加入过量浓硫酸后,只有SiO2不溶,同时Fe2+被氧化为Fe3+,并生成CaSO4沉淀,所以溶液中含有Fe3+、Al3+、Mg2+、Li+等离子,依据实验目的可知必须除去杂质离子,故在反应Ⅱ中加入碳酸钙的作用为:除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀,
故答案为:除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀;
(3)利用题干信息知反应Ⅲ要除去Mg2+,但在加入沉淀剂Ca(OH)2时会引入大量Ca2+,故还需加入Na2CO3除去Ca2+,即沉淀A为Mg(OH)2沉淀与CaCO3沉淀的混合物,反应的离子方程式为:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓,
故答案为:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓;
(4)实验室里分离固液混合物的操作是过滤,由题中给出Li2CO3的溶解度与温度的关系,可知洗涤Li2CO3沉淀要使用热水,
故答案为:热水;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)由有氧气产生可逆推知可能的原因:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,
故答案为:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
点评 本题考查了工业上以β-锂辉矿制取金属锂的方法,题目难度中等,试题涉及了化学式的书写、物质的分离与提纯、离子方程式的书写等知识,合理分析题中工艺流程是解题关键.


科目:高中化学 来源: 题型:选择题
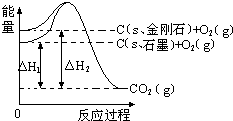
| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据一次能源与二次能源的划分,氢气为二次能源 | |
| B. | 空气、水、煤、天然气均为可再生资源 | |
| C. | 镁条燃烧时将部分化学能转化为光能 | |
| D. | 在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后的最高温度 |
| ① | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ④ | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-的空间构型是正四面体形 | |
| B. | CS2分子中各原子均达8电子稳定结构 | |
| C. | CH3-CH=CH2分子中碳原子的杂化类型有sp2和sp3两种 | |
| D. | H2O2分子是只含极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com