
下列关于化学与环境的叙述不正确的是()
A. 航天飞机上的隔离陶瓷属于复合材料
B. CO2和NO2是造成酸雨的主要原因
C. 燃煤中加入适量石灰石,可减少废气中SO2的含量
D. 垃圾是放错地方的资源,应分类回收利用
考点: 常见的生活环境的污染及治理.
分析: A.复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
B.二氧化碳与温室效应有关;
C.燃煤除硫,应加生石灰;
D.垃圾是放错地方的资源,应分类回收利用;
解答: 解:A.航天飞机机身上使用的隔热陶瓷瓦是由纤维和陶瓷复合而成的材料制成,其增强体多为碳纤维、碳化硅纤维和氧化硅纤维;基体的主要成分是各种陶瓷,故A正确;
B.大气中CO2浓度的增大,会加剧温室效应,不会导致酸雨的发生,故B错误;
C.燃煤除硫,应加生石灰,燃烧生成的二氧化硫与CaO反应生成亚硫酸钙,减少污染物的排放,故C正确;
D.垃圾是放错地方的资源,应分类回收利用,故D正确;
故选B.
点评: 本题考查常见的生活环境的污染及治理,把握酸雨及能源利用为解答的关键,注重化学与生活、环境保护的联系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在CCl4中的溶解度大,另一种为黄绿色,在CCl4中的溶解度较小,请回答下列问题:
(1)Pt(NH3)2 Cl2是平面正方形结构,还是四面体结构
(2)请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体: 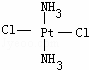 ,黄绿色固体:
,黄绿色固体:
(3)淡黄色固体物质是由 分子组成,黄绿色固体物质是由
分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在CCl4中溶解度比淡黄色固体小,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()
A. 1:2:3 B. 3:2:1 C. 6:3:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O 2C6H5OH+CO32﹣
2C6H5OH+CO32﹣
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ CO32﹣+2NH4++4Ag↓+6NH3+2H2O
CO32﹣+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某一有机物A(C6H12O2)可发生下列变化: 已知C为羧酸,且B不发生银镜反应,E能发生银镜反应,则A的可能结构有()
已知C为羧酸,且B不发生银镜反应,E能发生银镜反应,则A的可能结构有()
A. 6种 B. 8种 C. 9种 D. 13种
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院化学所研制的晶体材料﹣﹣纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下:FeCl3•6H2O FeOOH
FeOOH 纳米四氧化三铁,下列有关叙述不合理的是()
纳米四氧化三铁,下列有关叙述不合理的是()
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中反应的离子方程式的书写正确的是()
A. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混用会导致氯气中毒:ClO﹣+Cl﹣+2H+═Cl2↑+H2O
B. 水壶中水垢用食醋除去:2H++CaCO3═Ca2++CO2↑+H2O、
C. SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH═Na2SO4+H2O
D. 用FeSO4除去酸性废水中的Cr2O72﹣:Cr2O72﹣+Fe2++14H+═2Cr3++Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)⇌2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为( )
|
| A. | 1.6mol | B. | 1.2mol | C. | 大于1.6mol | D. | 小于1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)⇌3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L.
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为: (填“吸热”或“放热”)反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com