
【题目】已知柠檬酸易溶于水和乙醇,有酸性和还原性。用图示裝置(夹持和加热仪器已省略)制备补血剂甘氨酸亚铁![]() (易溶于水,难溶于乙醇)。下列说法错误的是( )
(易溶于水,难溶于乙醇)。下列说法错误的是( )
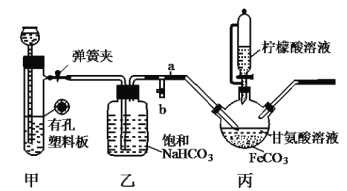
A.装置甲中所盛放的药品可以是石灰石和稀盐酸
B.加入柠檬酸溶液可调节溶液的![]() ,并防止
,并防止![]() 被氧化
被氧化
C.丙中反应方程式为![]()
D.洗涤得到的甘氨酸亚铁所用的最佳试剂是柠檬酸溶液
【答案】D
【解析】
甘氨酸亚铁中亚铁离子容易被空气中的氧气氧化,所以需要整个装置处于无氧环境,则甲装置的作用是产生某种气体将装置中的氧气排尽,乙装置为除杂装置,碳酸氢钠可以吸收酸性比碳酸强的酸性气体如HCl,可知该实验中利用CO2将装置中的空气排尽;之后利用甘氨酸和碳酸亚铁反应制备甘氨酸亚铁,柠檬酸溶液具有还原性和酸性,可以抑制亚铁离子被氧化和同时促进碳酸亚铁的溶解。
A.根据分析可知甲中可以利用石灰水和稀盐酸反应生成二氧化碳排尽装置中的空气,故A正确;
B.柠檬酸溶液有酸性和还原性,可以调节pH并防止亚铁离子被氧化,故B正确;
C.根据元素守恒以及要制备的目标产物可知丙中发生复分解反应,方程式为![]() ,故C正确;
,故C正确;
D.由于甘氨酸亚铁易溶于水,难溶于乙醇,用乙醇洗涤产品可以减少产品的溶解,提高产率和纯度,故D错误;
故答案为D。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水产养殖户常用电解法净化鱼池中的水,其工作原理如下图所示。下列说法中正确的是

A. X极是电源的负极,发生氧化反应
B. 工作过程中阴极区溶液的pH逐渐减小
C. 当电路中转移10mole-时,Ⅱ极上产生22.4LN2
D. I极上的电极反应式:C6H12O6-24e-+6H2O==6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 三氯甲烷中含有氯原子的数目为
三氯甲烷中含有氯原子的数目为![]()
B.![]() 葡萄糖中含羟基数目为
葡萄糖中含羟基数目为![]()
C.常温下,![]() 醋酸铵溶液(
醋酸铵溶液(![]() )中
)中![]() 与
与![]() 数目均为
数目均为![]()
D.![]() 和
和![]() 组成的混合物中含有的离子总数为
组成的混合物中含有的离子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式: ________________ 。
(2)用电子排布图表示D元素原子的价电子:__________。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的物质的量保持不变的是( )
A.C2H4、C2H6OB.C2H6、C2H6OC.C3H6、C2H4D.C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成了一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法不正确的是

A. X不能使酸性KMnO4溶液褪色
B. X的性质与烯烃类似,容易发生加成反应
C. X在常温下不能稳定存在
D. 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、 装置示意图和有关数据如下:

实验步骤:在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯 3.9 g。回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是_______________;第二次水洗的主要目的是____________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是______________________________。
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
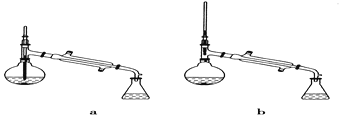
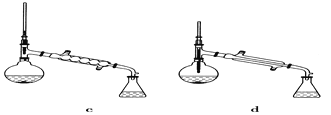
(6)本实验的产率是____________。
(7)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏____(填“高” 或“低”),其原因是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com