
A、B、C、D、E是5种短周期元素,原子序数逐渐增大,A的最简单气态氢化物是一种温室气体,A与C、B与C组成的化合物是机动车排出的大气污染物,C和D能形成原子个数比为1∶1和1∶2的两种化合物,E的最高价氧化物的水化物分别与B、D的最高价氧化物的水化物反应生成盐M和N。试回答下列问题:
(1)A在元素周期表中的位置是___,D2C2中含有的化学键有____________。
(2)工业合成B的气态氢化物BH3是放热反应。下列措施中,既能加快反应速率,又能提高原料转化率的是________(填字母序号)。实验室里检验BH3的方法是_________________。
a.升高温度 b.加入催化剂
c.将BH3及时分离出去 d.增大反应体系的压强
(3)盐M和盐N不能同时存在于水溶液中,用离子方程式表示其原因:__。
(4)A的最高价氧化物与D的最高价氧化物的水化物反应生成的正盐溶液呈________性,其原因是___________________(用离子方程式表示)。
(5)已知:A(s)+C2(g)=AC2(g) ΔH=-393.5 kJ·mol-1
AC(g)+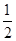 C2(g)=AC2(g) ΔH=-283.0 kJ·mol-1
C2(g)=AC2(g) ΔH=-283.0 kJ·mol-1
则A与C反应生成AC的热化学方程式为____________________________。
科目:高中化学 来源: 题型:填空题
三种短周期元素X、Y、Z,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体。已知X原子的最外层电子数是内层电子数的3倍,X和Y的单质直接化合形成气体A,X和Z的单质直接化合形成液态化合物B,Y和Z的单质直接化合形成的化合物C是一种无色有刺激性气味的气体。
请回答下列问题:
(1)Y元素在周期表中的位置是 。
(2)C可在X的单质中燃烧得到Y的单质和化合物B,利用此反应可制成新型的化学电源(KOH溶液做电解质溶液),两个电极均由多孔碳制成,通人的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质是 (填物质名称);负极的电极反应式为 。
(3)C与X的单质反应生成A的化学方程式为 。
(4)常温下,C的水溶液的pH=12,则该溶液中由水电离的C(OH-)= 。若向C溶液中加入等体积、等物质的量浓度的盐酸,所得溶液中水的电离程度 (填“大于”、“等于”或“小于”)相同条件下C溶液中水的电离程度。
(5)在2L密闭容器中放入1molC气体,在一定温度进行如下反应:
2C(g) 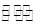 Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P l00 kPa | 4 | 4.6 | 5.4 | 5.8 | 6 | 6 |
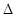 H=+67.7 kJ·mol-1。
H=+67.7 kJ·mol-1。 H="-534" kJ·mol-1。
H="-534" kJ·mol-1。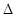 H= kJ·mol-1
H= kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是____________________________。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为____________;甲溶液中各离子浓度由大到小的顺序为________________(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为_________________________________________。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为________;实验测得丁溶液显弱酸性,由此你能得出的结论是___________________。
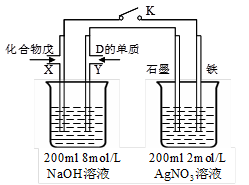
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池
|
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、L、M、Q的原子半径和主要化合价见下表
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键 B.极性键
C.非极性键 D.范德华力
E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构式。
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式: 。 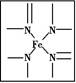
(2)血红素中N原子的杂化方式为 ,在如图的方框内用“→”标出Fe2+的配位键。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。 
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式: 。
(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。
(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分前36号元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X | 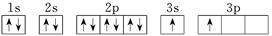 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com