
| A. | NaCl | B. | 肥皂 | C. | C17H35COONa | D. | 高级脂肪酸 |
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:实验题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 显蓝色,无明显现象 | B. | 显蓝色,出现红色沉淀 | ||
| C. | 无明显现象,无明显现象 | D. | 无明显现象,出现红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠能发生水解反应,可用作食品的膨松剂 | |
| B. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| C. | O3能使蛋白质发生变性,可用于杀菌、消毒 | |
| D. | SO2具有漂白性,可用KMn04标准溶液滴定食品中S02残留量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然油脂没有固定的熔、沸点 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | SO42-、NH4+、一定存在,Cl-可能不存在 | |
| C. | Cl-一定存在,且c(Cl?)≥0.4mol/L | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
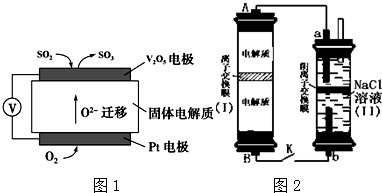
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com