
科目:高中化学 来源: 题型:
下列物质中的分子之间能形成氢键,且表示方法正确的是( )
A. H2O: H—O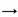 H B. H2S: H—S…H
H B. H2S: H—S…H
C. HCHO: C=O…H D. NH3: N—H…N
查看答案和解析>>
科目:高中化学 来源: 题型:
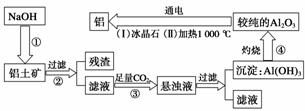
铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两 种提纯氧化铝的方案。
种提纯氧化铝的方案。
方案一:碱溶法
讨论回答下列问题:
(1)写出①、③两步骤中可能发生反应的 离子方程式。
离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶的白色固体,E则易溶于水,取A的 溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

(1)写出化学式:A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B:________________________________________________________________;
A→D:_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①中心原子采取sp3杂化的分子,其立体构形一定是正四面体;②分子晶体的熔点一定比金属晶体的低;③分子间作用力越大,分子越稳定;④离子晶体中,一定存在离子键;⑤非极性分子中一定含有非极性键;⑥ 原子晶体中,一定存在共价键;⑦固态不导电,熔融时能导电的晶体一定是离子晶体
A.①② ④ B.④⑤ ⑥ C.④ ⑥ ⑦ D.③ ④ ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
由—H、—CH3、 、—OH、—COOH五种原子或与原子团中的任意两种,两两组合形成的物质中,属于弱电解质的有机物有( )
、—OH、—COOH五种原子或与原子团中的任意两种,两两组合形成的物质中,属于弱电解质的有机物有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与B形成可使红色石蕊试纸变蓝的气体,A与C可形成化学式为A2C,A2C2的化合物,D的最高价氧化物对应水化物呈强碱性,B与E可形成三角锥型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是 ( )
A.离子半径:D+>E->C2->A+
B、A与B形成的物质,每个原子最外层都满足稀有气体稳定结构的分子只有BA3
C.C、D、E形成的化合物溶于水可呈弱碱性
D.B、C的简单氢化物形成的化合物前者稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com