
| 物质 | W | G | H | P |
| 反应前质量/g | 20 | 2 | 1 | 37 |
| 反应后质量/g | a | 32 | 1 | 12 |
| A. | a=5 | B. | H一定是该反应的催化剂 | ||
| C. | 该反应是化合反应 | D. | 在反应中,G、P的质量比为8:3 |
分析 H的质量不变,H可能起催化剂作用,G的质量增大32g-2g=30g,则G为生成物,P的质量减小37g-12g=25g,则P为反应物,由质量守恒定律,可知W为反应物,参加反应W为30g-25g=5g,据此解答.
解答 解:H的质量不变,H可能起催化剂作用,G的质量增大32g-2g=30g,则G为生成物,P的质量减小37g-12g=25g,则P为反应物,由质量守恒定律,可知W为反应物,参加反应W为30g-25g=5g.
A.由上述分析可知,a=20-5=15,故A错误;
B.H可能是催化剂,也可能与反应无关,故B错误;
C.反应物为两种,生成为一种,属于化合反应,故C正确;
D.在反应中,G、P的质量比为30g:25g=6:5,故D错误,
故选:C.
点评 本题考查化学方程式有关计算,涉及质量守恒定律、基本反应类型、催化剂特征等,关键是对质量守恒定律的理解.


科目:高中化学 来源: 题型:解答题
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
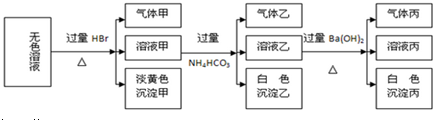
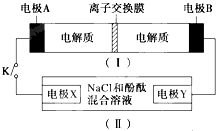 如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;2K2S2+KI3$?_{充电}^{放电}$K2S4+3KI,装置(Ⅱ)为电解池的示意图当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;2K2S2+KI3$?_{充电}^{放电}$K2S4+3KI,装置(Ⅱ)为电解池的示意图当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | 闭合K时,K十从左到右通过离子交换膜 | |
| B. | 闭合K时,A的电极反应式为:3I--2e-═I2- | |
| C. | 闭合K时,X的电极反应式为:2CI--2e-═Cl2↑个 | |
| D. | 闭合K时,当有0.1mo1K+通过离子交换膜,X电极上产生标准状况下气体2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组同学用如图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:
某小组同学用如图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl水溶液是强酸,任何强酸都导致有沉淀析出 | |
| B. | Cl-浓度增大,使平衡向生成氯化钠的方向移动,生成NaCl(s) | |
| C. | 酸的存在降低了Ksp(NaCl)的数值 | |
| D. | Ksp(NaCl)不受酸的影响,但增加Cl-浓度,能使Ksp(NaCl)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时漏斗下方紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 加热氯酸钾制取氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com