解:(1)在加热的条件下,二氧化锰把浓盐酸氧化,生成氯气,
反应的化学方程式是MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O,
故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O;
(2)已知氧化性强弱顺序为:NaBiO
3>PbO
2>MnO
2>Na
2O
2>FeCl
3,则可选用NaBiO
3、PbO
2,
由于过氧化钠和水反应生成氢氧化钠,与氯气反应,不能选用,氯化铁氧化性比氯气弱,不能用于制备氯气,
故答案为:A、C;
(3)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,
故答案为:①制取温度不同;②制取时碱的浓度也不同;
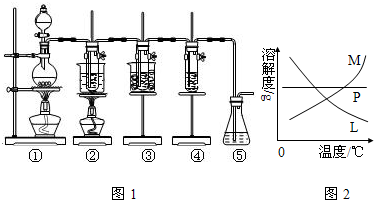
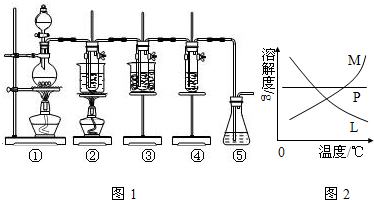
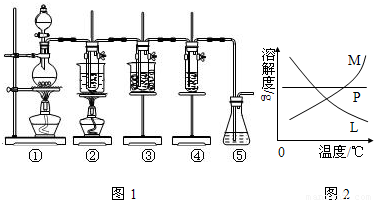
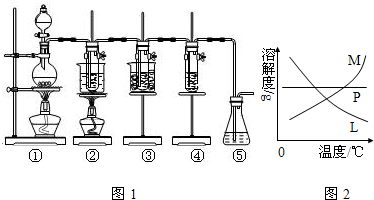
(4)反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,不溶性固体与液体的分离常采用过滤的方法,
故答案为:M;过滤;
(5)氯气溶于水生成次氯酸和盐酸,因为次氯酸具有强氧化性,能把石蕊试液氧化而褪色,不能证明氯气的强氧化性,
故答案为:不可;石蕊溶液褪色的是因为HClO的强氧化性而不是Cl
2;
(6)若②的试管溶液中不但有KClO
3生成还有KClO生成,且二者的物质的量之比为1:2,设生成1molKClO
3,
2molKClO.则失去电子数目为1×(5-0)+2×(1-0)=7,氯气被还原生成KCl,则应得到7mol电子,生成7molKCl,5Cl
2+10KOH

KClO
3+2KClO+7KCl+5H
2O,该反应中氧化剂和还原剂的物质的量之比为7:3,
故答案为:7:3.
分析:(1)在加热的条件下,二氧化锰和浓盐酸反应生成氯气、氯化锰和水;
(2)用来代替MnO
2制Cl
2的物质应具有强氧化性,注意不能和氯气反应生成其它物质;
(3)在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠;
(4)溶质的溶解度随温度的降低而降低;
(5)氯气和水反应生成次氯酸,次氯酸的氧化性比氯气强;
(6)根据氧化剂和还原剂之间得失电子数目相等计算.
点评:该题是中等难度的试题,试题综合性强,难易适中,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力.该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力.

 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O, MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; KClO3+2KClO+7KCl+5H2O,该反应中氧化剂和还原剂的物质的量之比为7:3,
KClO3+2KClO+7KCl+5H2O,该反应中氧化剂和还原剂的物质的量之比为7:3,