
某实验小组设计了下列装置进行氨的催化氧化实验。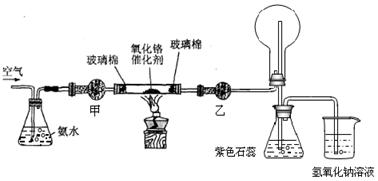
完成下列填空:
(1)常温下,氨水的浓度为1:1.5(28%的浓氨水和水的体积比)时实验现象明显,配制该浓度氨水的玻璃仪器有 。
(2)本实验用的干燥剂是碱石灰和无水氯化钙。则甲处是____________;乙处是___________。
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是_____(填“吸”或“放”)热反应;化学方程式为 。
(4)实验前,烧杯中盛有200mL 1.000 mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,且溶液质量比反应前增加了7.48g,则NaOH溶液吸收的NO和NO2的物质的量之比
是 (设溶液的体积不变且忽略盐类的水解)。
(5)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟。其原因可用化学方程式表示为: 、 。
(6)已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是 (填分子式);能用来冷冻物质的是 (填分子式)。
(1)量筒、烧杯、玻璃棒 (2分,缺一项得1分)
(2)甲处:碱石灰;(1分)乙处:无水氯化钙(1分)
(3)放热反应(1分); 4NH3+5O2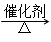 4NO+6H2O(1分)
4NO+6H2O(1分)
(4) 5:13(2分)
(5)4NO+3O2+2H2O→4HNO3(1分,或2NO+O2→2NO2和3NO2+H2O→2HNO3+ NO
或4NO2+O2+2H2O→4HNO3也给分);NH3+HNO3→NH4NO3(1分)
(6)NH3(1分);N2(1分)
解析试题分析:
(1)氨水的浓度为1:1.5,是体积比浓度,可以量取溶液体积混合得到,利用量筒量取氨水和水在烧杯中混合后,用玻璃棒搅拌得到配制的溶液;故答案为:量筒、烧杯、玻璃棒;
(2)甲处是干燥氨气需要用碱石灰,防止水蒸气进入玻璃管炸裂玻璃管,乙处是干燥一氧化氮气体用氯化钙,不吸收后再后续装置会生成白烟;氨气不能用氯化钙干燥;甲处:碱石灰;乙处:无水氯化钙;故答案为:碱石灰,氯化钙;
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,反应是放热反应,发生的是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2==4NO+6H2O故答案为:放热反应; 4NH3+5O2==4NO+6H2O;
(4)实验前,烧杯中盛有200mL 1.000mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,氢氧根离子浓度为0.1mol/L,且溶液质量比反应前增加了7.48g为一氧化氮和二氧化氮 气体质量,消耗氢氧化钠物质的量=0.2L×1mol/L-0.1mol/L×0.2L=0.18mol;设NO物质的量为x,NO2物质的量为y,得到: x+y=0.18 ; 28x+46y=7.48,解得x=0.05mol,y=0.13mol,NO和NO2的物质的量之比=0.05:0.13=5:13;故答案为:5:13;
(5)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟,氨气被氧化生成一氧化氮,一氧化氮和空气中的氧气反应生成二氧化氮,通入水中反应生成硝酸,硝酸和过量的氨气反应生成硝酸铵固体小颗粒,冒白烟;反应的很幸福陈楚生为:4NO+3O2+2H2O=4HNO3,或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;NH3+HNO3=NH4NO3;故答案为:4NO+3O2+2H2O→4HNO3,或2NO+O2→2NO2和3NO2+H2O→2HNO3+NO;或4NO2+O2+2H2O→4HNO3;NH3+HNO3→NH4NO3;
(6)沸点低的易气化吸收热量,可以做制冷剂,冷冻物质沸点高的液化后可以做冷冻物质的物质,已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是氨气;能用来冷冻物质的是氮气;故答案为:NH3;N2;
考点:考查:本题考查了氨气实验室制备,性质验证方法,氨气的催化氧化反应,气体干燥试剂选择,产物吸收,过程反应化学方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:实验题
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)A中制取Cl2的离子方
程式__________________
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2: 向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题: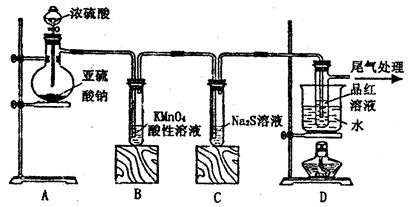
(1)装置A中盛放亚硫酸钠的仪器名称是___________,其中发生反应的化学方程式为_____________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________、_____________,这些现象分别说明SO2具有的性质是_________和___________;配平下面离子方程式:
□SO2+□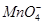 +□H2O=□
+□H2O=□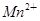 +□
+□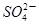 +□H+;
+□H+;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象______________________;
(4)尾气可采用____________________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组的同学为研究铜与浓硫酸的反应,分别设计了如下图所示的三套实验装置: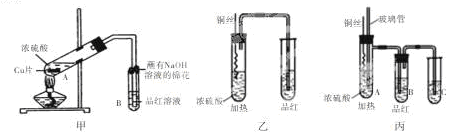
(1)该小组同学对这三套装置进行了评价,认为甲和乙装置各有优缺点,甲装置的优点是 ,乙装置的优点是 。
(2)丙装置综合了甲和乙的优点,是一套比较合理的装置,试管C中是 溶液,A中玻璃管可起到防止B中品红溶液倒吸的作用,其原理是 。
为使装置中残留气体完全被C溶液吸收,可采取的操作是 。
(3)写出丙装置中发生反应的化学方程式: ,该小组同学用丙装置进行实验过程中发现除了课本上描述的实验现象外,试管A内还生成了白色固体,白色固体成分可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。

请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
| 步骤 | 所选试剂 | 现象及结论 |
| 1 | | |
| 2 | | |
| 3 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。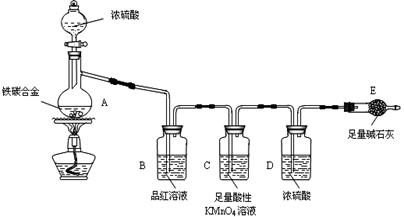
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)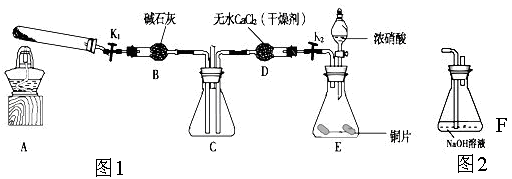
(1)E装置中制取NO2反应的离子方程式是 。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③ 。
(5)此实验装置存在一个明显的缺陷是 。
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据 ,下列说法不正确是
,下列说法不正确是
①X一定是单质;
②反应Ⅱ一定是化合反应;
③若强酸为HNO3,氧化物一定是酸性氧化物;
④若强碱为NaOH,氧化物一定是Na2O。
| A.①③ | B.②③ | C.②③④ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。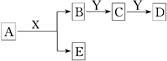
下列推断正确的是
A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com