

分析 (1)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,据此可以检验二氧化硫;
(3)二氧化硫具有还原性,能够被酸性高锰酸钾溶液氧化;
(4)用品红溶液具有是否存在二氧化硫气体;
(5)空气中含有大量二氧化硫气体,会组成酸雨现象;温室效应的罪魁祸首为二氧化碳.
解答 解:(1)碳与浓硫酸反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)反应中有二氧化硫生成,则图1A装置中品红溶液颜色褪色,证明了混合气体中含有SO2,
故答案为:褪色; SO2(或二氧化硫);
(3)酸性高锰酸钾溶液能够氧化二氧化硫,从而可以除去二氧化硫,证明了二氧化硫具有还原性,
故答案为:还原性;
(4)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接图2中的A-品红溶液,用于检验二氧化硫气体是否除尽,
故答案为:a;
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是酸雨,所以A正确;二氧化碳造成的环境影响主要是温室效应,所以C正确,
故答案为:A;C.
点评 本题考查了浓硫酸的性质,题目难度中等,明确浓硫酸与碳的反应原理及二氧化硫、二氧化碳的检验方法为解答关键,注意检验二氧化碳时,必须排除二氧化硫的干扰,为易错点.


科目:高中化学 来源: 题型:填空题
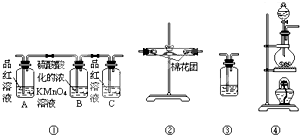 已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
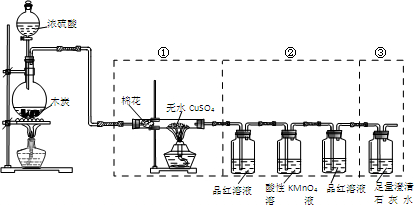
| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
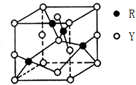 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com