
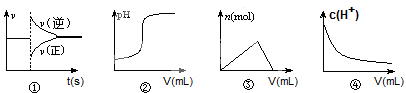
| A������ͼ�ٿ��Ա�ʾ��ѹ������ij��ѧƽ����ϵ���������������Ӧ������ʱ��ı仯 |
| B������ͼ�ڿ��Ա�ʾ��һ����������������Һ�еμ�һ��Ũ�ȵ�����ʱ��pH�ı仯 |
| C������ͼ�ۿ��Ա�ʾ��һ������������Һ�еμ�һ��Ũ�ȵ�����������Һʱ�IJ������������ʵ����仯 |
| D������ͼ�ܿ��Ա�ʾ�������ˮϡ��������Һ��c(H+)�ı仯 |
 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A������ɫ�ĵ�����Һ��ͨ������SO2������ɫ��Һ:I2+SO2+2H2O 2I-+SO42��+4H+ 2I-+SO42��+4H+ |
B����֪����ƽ�ⳣ��:H2CO3>HClO>HCO32��,��NaClO��Һ��ͨ������������̼:2ClO-+CO2+H2O 2HClO+CO42�� 2HClO+CO42�� |
C��NH4HCO3��Һ�����NaOH��Һ��Ӧ:NH4++OH- NH3��+H2O NH3��+H2O |
D��FeI2��Һ��ͨ�����Cl2:2Fe2++2I-+2Cl2 2Fe3++I2+4Cl- 2Fe3++I2+4Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��Na2O2��H2O��Ӧ:2 +2H2O +2H2O 4OH-+O2�� 4OH-+O2�� |
B��FeCl2��Һ��ϡ���ᷴӦ:Fe2++N +4H+ +4H+ Fe3++NO��+2H2O Fe3++NO��+2H2O |
C��CaCO3�������Һ��Ӧ:CaCO3+2H+ Ca2++CO2��+H2O Ca2++CO2��+H2O |
D��KAl(SO4)2��Һ�백ˮ��Ӧ:Al3++3NH3��H2O Al(OH)3��+3N Al(OH)3��+3N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��ʯ������Ca(OH)2�ĵ��룺Ca(OH)2(s) Ca2�� + 2OH�� Ca2�� + 2OH�� |
| B����AgC1����Һ�еμ�Na2S��Һ������ɫ������2AgC1(s) + S2���� Ag2S(s) + 2C1�� |
| C����NaHCO3��Һ�м��������ʯ��ˮ������ɫ������HCO3�� + Ca2�� + OH�� �� CaCO3��+ H2O |
D��Fe (OH)3������Ʊ���FeCl3+ 3H2O  Fe (OH)3�����壩+3HCl Fe (OH)3�����壩+3HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ͨ�������Һ�У� CH3COOH+NH3��CH3COONH4 |
| B������ϡ���ᷴӦ�� 2Fe+6H+ = 2Fe3++3H2�� |
| C������������ϡ��� Ba2++2OH-+2H++SO42-=BaSO4��+2H2O |
| D�����Ƽ���ˮ�У� Na��2H2O=Na++2OH-��H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ��ѧ��Ӧ�������ӷ���ʽ | ���� |
| A | Fe3O4��ϡ���ᷴӦ��2Fe3O4+18H+ =6Fe3++H2��+8H2O | ��ȷ |
| B | ��̼��þ�м���ϡ��� +2H+ =CO2��+H2O +2H+ =CO2��+H2O | ����̼��þ��Ӧд��������ʽ |
| C | ���������Һ�м�������������Һ�� Ba2++  =" " BaSO4�� =" " BaSO4�� | ��ȷ |
| D | FeBr2��Һ������ʵ�����Cl2��Ӧ�� 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | ����Fe2+��Br-�Ļ�ѧ������֮��ӦΪ1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
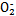 �������۳�ȥ����֪�˷�Ӧ��ϵ�к���Al��NaAlO2��NaNO2��NaOH��NH3��H2O��H2O�������ʡ�
�������۳�ȥ����֪�˷�Ӧ��ϵ�к���Al��NaAlO2��NaNO2��NaOH��NH3��H2O��H2O�������ʡ� �������س�ȥ������
�������س�ȥ������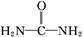 )��N
)��N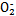 �����������·�Ӧ�������������塣�÷�Ӧ������16.8 L(������Ϊ��״��)�������ʱ,�������ص�����Ϊ�������� g��
�����������·�Ӧ�������������塣�÷�Ӧ������16.8 L(������Ϊ��״��)�������ʱ,�������ص�����Ϊ�������� g�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������Լ��Ե�ԭ��CO32��+ 2 H2O = H2CO3 + 2 OH�� |
B��ϡ�����ϡ����������Һ��Ӧ���к��ȡ�H=��57.3 kJ/mol����ϡ������ϡ����������Һ������Ӧ���Ȼ�ѧ����ʽ��ʾΪ��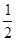 H2SO4(l)+ KOH(l) = H2SO4(l)+ KOH(l) = 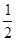 K2SO4 (l)+ H2O(l) ��H=��57.3 kJ/mol K2SO4 (l)+ H2O(l) ��H=��57.3 kJ/mol |
| C��������Һ�еμ�����������Һ�����������ʵ������ 2 Al3+ +3 SO42��+3 Ba2+ +6 OH�� =" 2" Al(OH)3 ��+ 3 BaSO4 �� |
D��ͭ��Ũ�����ϼ��ȣ�2H2SO4��Ũ��+Cu SO2��+Cu2+ +SO42��+2 H2O SO2��+Cu2+ +SO42��+2 H2O |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com