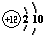分析:A.质的量浓度中体积是指溶液的体积,不是溶剂的体积;
B.Cu与浓硫酸反应,随反应进行,浓硫酸变稀,而稀硫酸不与Cu反应;
C.34.2 g Al
2(SO
4)
3的物质的量为0.1mol,于水配成100 mL溶液,所得Al
2(SO
4)
3溶液浓度为1mol/L,溶液时均匀的,取出10mL溶液的浓度与原溶液浓度相等,由于Al
3+水解,其浓度小于2 mol/L;
D.根据c=
进行计算.
解答:解:A.将0.1mol CuSO
4?5H
2O晶体溶于水配成100 mL溶液,溶液物质的量浓度为1 mol?L
-1,物故A错误;
B.Cu与浓硫酸反应,随反应进行,浓硫酸变稀,而稀硫酸不与Cu反应,由Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O可知,含0.2mol H
2SO
4的浓硫酸与足量的铜共热反应,生成SO
2气体小于0.1mol,故B错误;
C.34.2 g Al
2(SO
4)
3的物质的量为0.1mol,于水配成100 mL溶液,所得Al
2(SO
4)
3溶液浓度为1mol/L,溶液时均匀的,取出10mL溶液的浓度与原溶液浓度相等,由于Al
3+水解,其浓度小于2 mol/L,故C错误;
D.KCl溶液的密度为1.174 g?cm
-3,物质的量浓度为4.0 mol?L
-1,根据c=
可知,此溶液中KCl的质量分数为
×100%,故D正确,
故选D.
点评:本题考查物质的量浓度有关计算,难度中等,C选项中注意离子水解,D选项中注意物质的量浓度与质量分数的关系.



 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案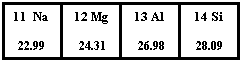 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )