
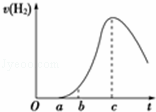
将在空气中久置的铝片与0.5mol•L﹣1硫酸反应,产生氢气的速率与反应时间可用如图所示的曲线表示,试回答下列问题.
(1)曲线O→a段不产生氢气的主要原因是(用有关化学方程式表示): .
(2)曲线b→c段产生氢气的速率增加较快的主要原因是 .
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: (1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,根据氧化铝的性质分析;
(2)金属和酸的反应是放热反应,温度升高是影响反应速率的主要因素,根据温度对化学反应速率的影响分析.
解答: 解:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2,离子方程式为Al2O3+3H2SO4=2Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4=2Al2(SO4)3+3H2O;
(2)金属和酸的反应是放热反应,使溶液的温度升高,温度升高是影响反应速率的主要因素,化学反应速率加快,
故答案为:反应放热,温度升高是影响反应速率的主要因素,使反应速率增大.
点评: 本题考查了化学反应速率的影响因素,难度不大,注意根据图象分析理解随反应进行影响反应速率的主导元素.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()
A. 处理过程中银器一直保持恒重
B. 银器为正极,Ag2S被还原生成单质银
C. 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D. 黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
固体NH4Br置于密闭容器中,某温度下发生反应:NH4Br(s)⇌NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g),2min后测知H2的浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,则下列速率正确的是()
A. 0.5mol•L﹣1•min﹣1 B. 2.5mol•L﹣1•min﹣1
C. 2mol•L﹣1•min﹣1 D. 1.25mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是()
A. HCl和NaOH反应的中和热△H=﹣5 7.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
7.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
B. 碳与二氧化碳的反应既是吸热反应,又是化合反应
C. 热化学方程式中化学计量数可表示分子个数
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
已知胆矾溶于水时溶液温 度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s)
度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s) CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为()
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为()
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol﹣1(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 凡是放热反应都是自发的,由于吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/℃ 700 900 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
回答下列问题:
(1)该反应的△H 0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为80%,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是 (填序号).
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的 值为 .
值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在研究金属钠与水的反应实验中,反应过程中所观察到的实验现象与金属钠的下列性质无关的是()
A. 熔点低 B. 密度小 C. 硬度小 D. 化学性质活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com