

分析 A 和G都为常见金属单质,F和G在高温下反应生成A和H,则该反应为铝热反应,则A为Fe,G为Al,H为Al2O3,氧化铝与氢氧化钠反应生成I为NaAlO2,通入过量二氧化碳得K为Al(OH)3沉淀,A与盐酸反应生成B为FeCl2,FeCl2与氢氧化钠反应生成C为Fe(OH)2,氯化亚铁与氯气反应生成D为FeCl3,氯化铁与氢氧化钠反应生成E为Fe(OH)3,氢氧化铁受热分解得F为Fe2O3,据此答题.
解答 解:A 和G都为常见金属单质,F和G在高温下反应生成A和H,则该反应为铝热反应,则A为Fe,G为Al,H为Al2O3,氧化铝与氢氧化钠反应生成I为NaAlO2,通入过量二氧化碳得K为Al(OH)3沉淀,A与盐酸反应生成B为FeCl2,FeCl2与氢氧化钠反应生成C为Fe(OH)2,氯化亚铁与氯气反应生成D为FeCl3,氯化铁与氢氧化钠反应生成E为Fe(OH)3,氢氧化铁受热分解得F为Fe2O3,
(1)根据上面的分析可知,B为FeCl2,H为Al2O3,
故答案为:FeCl2;Al2O3;
(2)反应①(B到D)的离子方程式2Fe2++Cl2=2Fe3++2Cl-,反应②(C到E)的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,反应⑤的化学方程式为AlO2-+CO2+2 H2O═Al(OH)3+HCO3-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;4Fe(OH)2+2H2O+O2=4Fe(OH)3;AlO2-+CO2+2 H2O═Al(OH)3+HCO3-;
(3)F为Fe2O3,A为Fe,反应③为铝热反应,反应中每转移3mol电子得到1mol铁,所以若反应中转移了0.3mol电子,则生成铁为0.1mol,其质量为5.6克,
故答案为:5.6.
点评 本题以铁、铝为载体考查了无机物的推断,熟悉物质的性质是解本题关键,根据物质的特殊颜色及物质的转化关系为突破口采用正逆相结合的方法进行推断,再结合物质的性质分析解答,总结归纳元素化合物知识,形成知识网络,灵活运用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2=2SO3△H=-196.6kJ•mol-1 | |
| B. | N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1 | |
| C. | C(s)+O2(g)=CO2(g)△H=+393.51kJ•mol-1 | |
| D. | H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4 固体于试管中,加入一定量水溶解 | |
| 步骤二: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧生成Na2O | |
| B. | 热稳定性,Na2CO3比NaHCO3强,而水溶性,NaHCO3 比Na2CO3易溶于水 | |
| C. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液一定存在Na+,不存在K+ | |
| D. | 将Na投入NH4Cl溶液中可生成两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
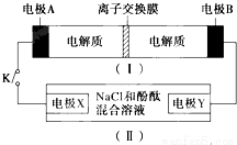
| A. | 闭合K时,X的电极反应式为:2H++2e-═H2↑ | |
| B. | 闭合K时,A电极反应式为:NiO2+2e-+2H+═Ni(OH)2 | |
| C. | 给装置(Ⅰ)充电时,B极参与反应的物质被氧化 | |
| D. | 给装置(Ⅰ)充电时,OH-通过阴离子交换膜,移向A电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com