
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.225mol/L |
| D、无法计算 |
| 2.56g |
| 64g/mol |
| 3 |
| 8 |
| 0.03mol |
| 0.1L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、碱性氧化物:Na2O、CaO、MgO、Na2O2 |
| B、碱:NaOH、KOH、Ba(OH)2、Na2CO3 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、非金属氧化物:CO2、NO、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
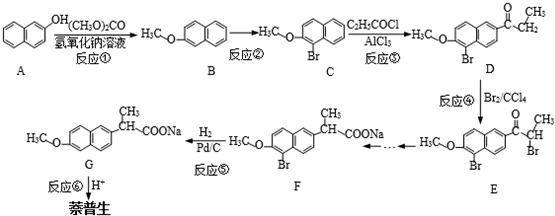
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是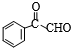 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| O2 |
| 催化剂 |
| Na |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O和F无正化合价 |
| B、1mol O2参加反应,转移1mol e- |
| C、上述反应中O2作氧化剂 |
| D、上述反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
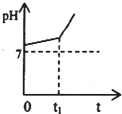 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:| [NH3?H2O] |
| [NH4+][OH-] |
| 5.56 |
| c(Ca2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO | ||||
| 方法Ⅱ | 电解法,反应为2Cu+H2O
| ||||
| 方法Ⅲ | 用肼(N2H4)还原新制的Cu (OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com