
DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
工业制备二甲醚(CH3OCH3)在催化反应室中(压强2.0-10.0Mpa,温度230-2800C)进行下列反应:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H = —90.7kJ·mol—1
CH3OH(g) △H = —90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H = —41.2kJ·mol—1
CO2(g)+H2(g)△H = —41.2kJ·mol—1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H =
CH3OCH3(g)+CO2(g),则该反应的△H =
②下列有关反应Ⅲ的说法正确的是
A.在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变。
B.某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大
C. 若830℃时反应③的K=1,则在催化反应室中反应Ⅲ的K>1.0
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
CH3OCH3(g)+3H2O(g)△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器内压强保持不变
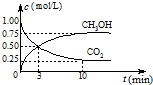
(3)二甲醚也可以通过CH3OH分子间脱水制得
在 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
①该条件下反应平衡常数表达式K=______根据图中数据计算 时该反应的平衡常数为
时该反应的平衡常数为
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为: 、
、 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)下图为二甲醚燃料电池的工作原理示意图。
请回答下列问题:
①A电极是 极。
②B电极上发生的电极反应式是 。
(1)-246.1 kJ·mol—1(2分,未写单位扣1分); C (2分)
(2)B、D(2分,错选1个扣1分)
(3) ①表达式略(2分) 5 (2分) ②>(2分)
(4)①正(2分),②CH3OCH3+3H2O-12e—=2CO2+12H+(2分,二甲醚写分子式不扣分)
解析Ⅰ.CO(g)+2H2(g) CH3OH(g) △H1 = —90.7kJ·mol—1
CH3OH(g) △H1 = —90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 = —23.5kJ·mol—1
CH3OCH3(g)+H2O(g) △H2 = —23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H3 = —41.2kJ·mol—1
CO2(g)+H2(g) △H3 = —41.2kJ·mol—1
△H =2△H1+ △H2+△H3=-246.1 kJ·mol—1
②下列有关反应Ⅲ的说法正确的是 B、D
在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、m、n不变V可变,混合气体平均相对分子质量M=m/n不变、密度改变,A错误。某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大。若830℃时反应③的K=1,


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 太阳光 |
| 高温 |
| 7 |
| 448 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| 太阳光 |
 CO+3H2
CO+3H2 CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 太阳光 |
| 高温 |

| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
工业制备二甲醚(CH3OCH3)在催化反应室中(压强2.0-10.0Mpa,温度230-2800C)进行下列反应:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H =—90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H =—23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2kJ·mol—1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H=
②下列有关反应Ⅲ的说法正确的是
A.在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变。
B.某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大
C. 若830℃时反应③的K=1,则在催化反应室中反应Ⅲ的K>1.0
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器内压强保持不变
(3) 二甲醚也可以通过CH3OH分子间脱水制得
在,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
①该条件下反应平衡常数表达式K=______根据图中数据计算时该反应的平衡常数为
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为:
、
此时正、逆反应速率的大小:
_______
(填“>”、“<”、或“=”)。
(4)下图为二甲醚燃料电池的工作原理示意图。
请回答下列问题:
①A电极是 极。
②B电极上发生的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com