
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。
① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O
(1)配平上述反应
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液, 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。
(1)2NaIO3 + 6NaHSO3 =2NaI + 3Na2SO4 + 3H2SO4 IO3-+5I-+6H+= 3I2+3H2O
(2)5/3mol 2mol (3)1.0×10-12,增大,增大,增大
解析试题分析:(1)这两个反应均为氧化还原反应,要符合电子守恒和原子守恒。对第二个反应来说,是离子反应,还要符合电荷守恒。配平后的方程式为:2NaIO3 + 6NaHSO3 =2NaI + 3Na2SO4 + 3H2SO4 IO3-+5I-+6H+= 3I2+3H2O (2)开始产生I2时,第一个反应恰好完成,第二个反应刚刚开始。有方程式2NaIO3 + 6NaHSO3 =2NaI + 3Na2SO4 + 3H2SO4可知:n(NaIO3):n(NaHSO3)=2:6=1:3,所以n(NaIO3)="1/3" n(NaHSO3) = 1/3×5mol=5/3mol.产生单质I2最大值时第一个反应产生的I-完全发生第二个反应。n(I-)= 1/3n(NaHSO3)= 5/3 mol,发生第二个反应消耗的NaIO3的物质的量为n(NaIO3)=1/5×5/3mol=1/3mol.所以一共消耗的的NaIO3的物质的量为n(NaIO3)= 5/3mol+1/3mol=2mol.(3) H2SO3 HSO3- + H+的电离常数Ka= {C(H+)·C(HSO3-)} ÷C(H2SO3)= 1×10-2 mol/L; NaHSO3的水解平衡为HSO3-+H2O
HSO3- + H+的电离常数Ka= {C(H+)·C(HSO3-)} ÷C(H2SO3)= 1×10-2 mol/L; NaHSO3的水解平衡为HSO3-+H2O H2SO3 + OH-。水解平衡常数Kh=" {" C(OH-)·C(H2SO3)}÷{ C(HSO3-)·C(H2O)}. Ka·Kh= {C(H+)·C(OH-)}÷C(H2O). Kh= {C(H+)·C(OH-)} ÷{C(H2O)·Ka } =1.0×10-14÷1.0×10-2=1.0×10-12. 若向NaHSO3溶液中加入少量的I2,会发生反应:H2SO3+ I2+H2O= H2SO4+ 2HI;使平衡H2SO3
H2SO3 + OH-。水解平衡常数Kh=" {" C(OH-)·C(H2SO3)}÷{ C(HSO3-)·C(H2O)}. Ka·Kh= {C(H+)·C(OH-)}÷C(H2O). Kh= {C(H+)·C(OH-)} ÷{C(H2O)·Ka } =1.0×10-14÷1.0×10-2=1.0×10-12. 若向NaHSO3溶液中加入少量的I2,会发生反应:H2SO3+ I2+H2O= H2SO4+ 2HI;使平衡H2SO3 HSO3- + H+向逆反应方向移动,则溶液中
HSO3- + H+向逆反应方向移动,则溶液中 将增大。若加入少量NaOH溶液,由于发生反应:H++OH-= H2O,使平衡HSO3 -
将增大。若加入少量NaOH溶液,由于发生反应:H++OH-= H2O,使平衡HSO3 - SO32- + H+向正反应方向移动,
SO32- + H+向正反应方向移动, 的值增大。若加入少量水,盐的水解程度增大,使水的电离程度也增大。
的值增大。若加入少量水,盐的水解程度增大,使水的电离程度也增大。
考点:考查硫酸工厂尾气处理问题及外界条件对盐的水解平衡、电离平衡的影响等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
已知 2Na2O2+2CO2=2Na2CO3+O2,因此Na2O2可在呼吸面具和潜水艇里作供氧剂。
(1)请在答卷上用双线桥法标出上述方程式的电子转移方向和数目。
(2) 是还原剂, 是还原产物。
(3)若转移3mol电子,则所产生的氧气在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 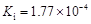 |  | 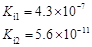 | 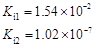 |
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O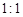 ,试配平上述化学方程式。
,试配平上述化学方程式。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)下列反应原理可以用于检查司机是否酒后开车。
K2Cr2O7+C2H5OH+H2SO4—Cr2(SO4)3+CH3COOH+K2SO4+
(1)在反应中,氧化剂是 。如果在反应中生成1molCr3+,转移电子数为 。(用NA表示阿伏加德罗常数)
(2)写出上述化学方程式所缺项(填化学式) 。
(3)乙醇(C2H5OH)和乙醚(CH3CH2OCH2CH3)的沸点分别是78.5℃、34.5℃,分离二者混合物的方法是 ,乙醇比乙醚的沸点高的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+ HCl(浓)= KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是 , ClO2是反应的 (填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的 倍。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为 mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为 、 。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应配平后的离子方程式____________________。
(2)不同条件下高锰酸钾可发生不同如下反应:
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH- MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与 有关。
(3)高锰酸钾可代替二氧化锰用来制取Cl2,反应中氧化剂和还原剂物质的量之比为_____________。
(4)高锰酸钾溶液与硫化亚铁在酸性条件下发生如下反应:
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锆(Zr)是一种重要的稀有元素。
(1)由锆英石(ZrSiO4)可制取ZrOC12-8H2O
①用碳熔炼锆英石制碳化锆的化学方程式为:ZrSiO4+3C ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
②用烧碱熔ZrC制取Na2ZrO3,完成该反应的化学方程式:
□ZrC+□NaOH+□ 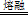 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O
③碱熔料用盐酸浸出可得ZrOC12溶液。通过蒸发结晶从该溶液中获得ZrOC12-8H2O,还需用浓盐酸控制酸度,原因是 。
(2)ZrOC12-8H2O具有多方面的用途。用ZrOC12-8H2O和YC13制备Y2O3--ZrO2复合粉体的流程如下:
①共沉淀时,生成Zr(OH)4的化学方程式为 。
②当共沉淀恰好完全时,溶液中c(Zr4+)= 。
(已知Ksp[Zr(OH)4]=6.4×10—49,Ksp[Y(OH)3]=8.0×10—23;溶液中离子浓度为1×10-5mol?L-1时,可认为沉淀完全)
③将制得的一种复合粉体溶于水后,测得其微粒的平均直径为30 nm,该分散系属于 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com