
| A. | 质子数c>d | B. | 非金属性Y<Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径W>X |
分析 元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,以此解答该题.
解答 解:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.离子的电子层结构相同,则c+2=d+1,则质子数d>c,故A错误;
B.Y是O、Z是F元素,同一周期元素,非金属性随着原子序数增大而增强,所以非金属性Y<Z,故B正确;
C.非金属性越强,其氢化物的稳定性越强,非金属性Y<Z,则氢化物的稳定性H2Y<HZ,故C错误;
D.W是Al元素、X是Na元素,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W<X,故D错误;
故选B.
点评 本题考查原子结构和元素性质,为高频考点,正确判断元素是解本题关键,熟练掌握同一周期、同一主族元素原子结构、元素性质递变规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
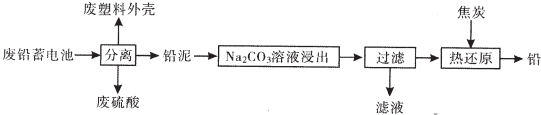
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变,充入水蒸气使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲醛的电子式: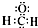 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: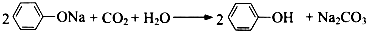 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
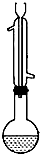 下列实验设计或操作合理的是BGH
下列实验设计或操作合理的是BGH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1 mol/L氨水中含有0.1NA NH3分子 | |
| B. | 46gNO2和N2O4混合气体中含有的原子数为3NA | |
| C. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| D. | 常温常压下,12g 14C所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
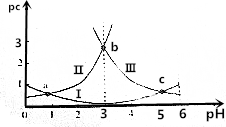
| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com