
【题目】下列说法正确的是
A.离子化合物中一定含有金属元素B.原子晶体熔化要破坏共价键
C.构成分子晶体的微粒中一定含有共价键D.只有离子化合物中才存在离子
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( ) 
A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1mol Cu2O生成
C.图二装置中发生:Cu+2Fe3+═Cu2++2Fe2+ , X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国古代四大发明之一,由硫磺、火硝和木炭粉均匀混合而成,点燃后可能发生的反应:S+2KNO3+3C=N2↑+3CO2↑+X(已配平),则物质X是
A. K2S B. SO2 C. H2S D. SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气” 或“无法确定”)
(2)写出C装置中反应的化学方程式:_________
(3)若装置是不漏气的,打开止水夹a后,用上述装置进行实验。写出A中发生反应的化学方程式,并用双线桥标出化合价变化情况、电子转移的方向和数目及被氧化还原情况 _________
(4)B装置中盛放的试剂是__________,其作用是___________ D仪器名称是 _____
(5)Fe(OH)2 在潮湿空气中变成灰绿色、红褐色:_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
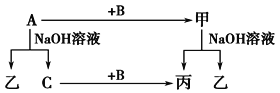
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯酚钠溶液中通入少量二氧化碳,发生反应:C6H5ONa+ CO2+ H2O→ C6H5OH+ NaHCO3,该反应证明苯酚钠的碱性强于
A.苯酚B.碳酸钠C.碳酸氢钠D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铁铜合金中加入过量的硝酸溶液,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全.若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸.则反应中消耗的NaOH溶液的体积是( )
A.150ml
B.180ml
C.200ml
D.250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是向MgCl2、AlCl3混合溶液中,开始滴加7 mL试剂A,之后改滴加试剂B,所得沉淀物质的量y (mol) 与试剂体积V(mL)间的关系如图所示。(试剂A、B分别是NaOH 溶液盐酸中的一种)
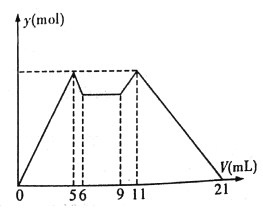
以下结论不正确的是
A. A是NaOH 溶液,B是盐酸
B. 原混合液中,c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. 从6 到9 的过程中,发生的反应的离子反应方程式是H+ +OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。请你根据所学知识回答下列问题:
(1)上述反应中____是氧化剂,该反应中氧化产物与还原产物的物质的量之比为____。
(2)把氯气通入紫色石蕊溶液中,可以观察到的现象是:______________________。
(3)实验室配制好2.0 mol·L-1的NaOH溶液,需要这种溶液____mL才能与2.24 L氯气(标准状况)恰好完全反应。
(4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式______________。
(5)现需490 mL 2.0 mol·L-1 NaOH溶液:
①所需称量的氢氧化钠固体的质量是____。
②上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、______。
③在配制溶液的过程中,下列操作可能造成结果偏高的是____。
A.定容时俯视
B.容量瓶不干燥,含有少量蒸馏水
C.溶解所用烧杯未洗涤
D.NaOH溶解后,未冷却即进行实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com