
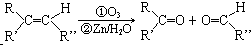

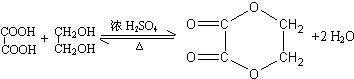 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、
;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、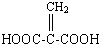 (写结构简式).
(写结构简式). 分析 A分子式为C10H18O3,具有酸性,说明A中含有羧基,A分子的不饱和度=$\frac{2×10+2-18}{2}$,说明A中含有两个双键,因为含有羧基,所以碳氧之间存在一个双键,则该反应中还含有一个双键,含有一个醇羟基;A能发生反应生成B和C,结合题给信息知,A中含有碳碳双键;
B能被NaOH溶液中和说明B中含有羧基,B能和银氨溶液发生银镜反应,说明B中含有醛基,D中含有两个羧基,D和F反应生成G,G是六元环状化合物,分子式为C4H4O4,则G是乙二酸乙二酯,所以D是HOOCCOOH,F是HOCH2CH2OH,F发生氧化反应生成E,E发生氧化反应生成HOOCCOOH,则E是OHCCHO,根据碳原子守恒知,B的结构简式为:OHCCOOH;
C中没有支链,也不含-CH3,则醇羟基处于边上,结合题给信息知,C的结构简式为:OHC(CH2)6CH2OH,根据碳碳双键的断键方式知,A的结构简式为:HOOCCH=CH(CH2)6CH2OH,据此分析解答.
解答 解:A分子式为C10H18O3,具有酸性,说明A中含有羧基,A分子的不饱和度=$\frac{2×10+2-18}{2}$,说明A中含有两个双键,因为含有羧基,所以碳氧之间存在一个双键,则该反应中还含有一个双键,含有一个醇羟基;A能发生反应生成B和C,结合题给信息知,A中含有碳碳双键;
B能被NaOH溶液中和说明B中含有羧基,B能和银氨溶液发生银镜反应,说明B中含有醛基,D中含有两个羧基,D和F反应生成G,G是六元环状化合物,分子式为C4H4O4,则G是乙二酸乙二酯,所以D是HOOCCOOH,F是HOCH2CH2OH,F发生氧化反应生成E,E发生氧化反应生成HOOCCOOH,则E是OHCCHO,根据碳原子守恒知,B的结构简式为:OHCCOOH;
C中没有支链,也不含-CH3,则醇羟基处于边上,结合题给信息知,C的结构简式为:OHC(CH2)6CH2OH,根据碳碳双键的断键方式知,A的结构简式为:HOOCCH=CH(CH2)6CH2OH,
(1)B的结构简式为:OHCCOOH,B中的官能团名称为醛基和羧基,故答案为:醛基和羧基;
(2)在加热条件下,乙二醛和氢氧化铜悬浊液发生反应生成乙二酸,反应方程式为:OHCCHO+4 Cu(OH)2 $\stackrel{△}{→}$HOOCCOOH+2 Cu2O↓+4 H2O,
故答案为:OHCCHO+4 Cu(OH)2 $\stackrel{△}{→}$HOOCCOOH+2 Cu2O↓+4 H2O;
(3)在浓硫酸作催化剂、加热条件下,乙二酸和乙二醇发生酯化反应,反应方程式为: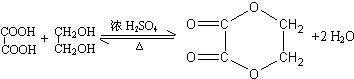 ,G是乙二酸乙二酯,分子中有2个羧基.且能使Br2的CCl4溶液褪色说明含有碳碳双键,则符合条件的G的同分异构体有HOOC-CH=CH-COOH,
,G是乙二酸乙二酯,分子中有2个羧基.且能使Br2的CCl4溶液褪色说明含有碳碳双键,则符合条件的G的同分异构体有HOOC-CH=CH-COOH,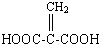 ,
,
故答案为: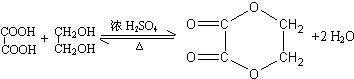 ;HOOC-CH=CH-COOH、
;HOOC-CH=CH-COOH、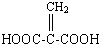 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及信息获取和运用能力,根据B的性质和G的分子式与结构为突破口来推断B,再结合题给信息进行分析解答,从而确定A的结构简式,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn | B. | Fe | C. | Mg | D. | Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
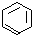 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com