
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大X浓度使平衡向生成Z的方向移动,X体积分数减小
D. 改变温度可以改变此反应的平衡常数
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法不正确的是( )
A. 淀粉除做食物外,主要用来生产葡萄糖和酒精
B. 海水淡化能解决淡水供应危机,利用离子交换法可以使海水淡化
C. 正丁烷、异丁烷的沸点依次降低
D. 糖类、蛋白质、脂肪是人体必需的营养物质。它们一定条件下都能发生水解和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL 0.018mol/L![]() 溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知:
溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知: ![]() ,则生成沉淀后的体系中
,则生成沉淀后的体系中![]() 为(忽略溶液体积变化)
为(忽略溶液体积变化)
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Na2CO3和NaHCO3两种白色固体物质欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:
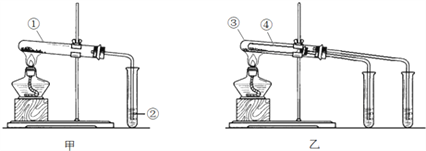
请回答:
(1)如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是______________(填字母).
a.稀HSO4 b.NaOH溶液 c.Ca(OH)2溶液
(2)如乙图所示,试管④中装入的固体应该是_________(填化学式).
(3)通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性_______(填“强”或“弱”).
(4)欲鉴别两种物质的溶液可选用的试剂是________________
(5)等物质的量浓度两种物质的溶液与同浓度的盐酸反应,反应速率快的是_________(填化学式)
(6)除去碳酸钠粉末中混入的碳酸氢钠杂质用______方法,化学方程式_____________________________
(7)除去碳酸氢钠溶液中混入的硅酸钠杂质的试剂是______,所采用的分离方法______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述正确的是
A.苯和乙烯都能使溴水褪色,且反应原理相同
B.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
C.用乙烷或乙烯制备氯乙烷的反应类型完全相同
D.苯甲醇与苯酚均能与Na反应,两者是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是 ( )
A. NaHS 溶于水: NaHS=Na+ + HS- HS- + H2O![]() H3O+ + S2-
H3O+ + S2-
B. (NH4)2SO4溶于水: (NH4)2SO4![]() 2NH4+ + SO42-
2NH4+ + SO42-
C. 磷酸溶于水中: H3PO4![]() 3H+ + PO43-
3H+ + PO43-
D. Al(OH)3的电离: Al(OH)3![]() Al3+ + 3OH-
Al3+ + 3OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]目前半导体生产正在进行一场“铜芯片”革命:在硅芯片上用铜代替铝布线。古老的金属铜在现代科技应用上取得了突破。用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
![]()
(1)基态铜原子的价电子排布式为____________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是_________,其立体结构是________,与该分子互为等电子体的单质气体的化学式是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为 ;
沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为 ;
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。铜晶体中铜原子堆积模型为________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。(用含d和NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式(在101kPa时):S(s)+02(g)==SO2(g);△H=-297.23kJ/mol,分析下列说法中不正确的是
A.1mol S完全燃烧时放出的热量为297.23kJ
B.S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ
C.S(g)+O2(g)=SO2(g)放出的热量小于297.23KJ
D.形成1mol SO2的化学键所释放的总能量大于断裂lmol S(s)和1mol O2(g)的化学键所吸收的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com