
【题目】在某密闭恒容容器中发生反应:X(g) ![]() Y(g)+nZ(g) ΔH=+QkJ/mol(Q>0)。反应体系2min时达到 平衡后,各物质的浓度在不同条件下的变化如下图所示。(第10min到16min的X浓度变化曲线未标出),下列说法不正确的是
Y(g)+nZ(g) ΔH=+QkJ/mol(Q>0)。反应体系2min时达到 平衡后,各物质的浓度在不同条件下的变化如下图所示。(第10min到16min的X浓度变化曲线未标出),下列说法不正确的是
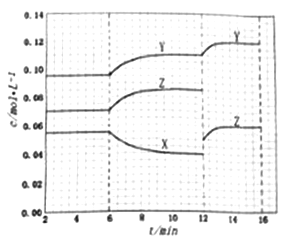
A. 反应方程式中n=1
B. 12min-14min内,用Y表示的评价速率为0.005mol/(L·min)
C. 在6min-10min内,反应吸收的热量为0.015Q kJ
D. 第12min时,Z曲线发生变化的原因是移走一部分Z
【答案】C
【解析】A. 根据图像可知6min~12min时X减少了0.055mol/L-0.040mol/L=0.015mol/L,Z增加了0.085mol/L-0.070mol/L=0.015mol/L,因此反应方程式中n=1,A正确;B. 12min-14min内,用Y表示的评价速率=![]() =0.005mol/(L·min),B正确;C. 在6min-10min内X减少了0.055mol/L-0.040mol/L=0.015mol/L,但容器容积未知。因此不能计算反应吸收的热量,C错误;D. 第12min时Z的浓度瞬间减小,随后逐渐增大,这说明Z曲线发生变化的原因是移走一部分Z,D正确,答案选C。
=0.005mol/(L·min),B正确;C. 在6min-10min内X减少了0.055mol/L-0.040mol/L=0.015mol/L,但容器容积未知。因此不能计算反应吸收的热量,C错误;D. 第12min时Z的浓度瞬间减小,随后逐渐增大,这说明Z曲线发生变化的原因是移走一部分Z,D正确,答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为目标产物,即原子利用率为100%。利用以下各种化学反应类型的合成过程最符合绿色化学的是
A.取代反应 B.水解反应 C.加聚反应 D.缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.在合成氨的工业生产中要及时将生成的氨分离出去
B.对 2HI(g) H2(g)+I2(g)平衡体系,增大压强可使颜色变深
C.溴水中有下列平衡 Br2+H2OHBr+HBrO,当加入 AgNO3 溶液后,溶液颜色变浅
D.合成氨反应,为提高氨的产率,理论上不宜采用高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 纳米泡沫碳与金刚石互为同位素 B. H2O与D2O互为同分异构体
C. CH3CH2COOH与CH3COOH互为同系物 D. C3H8的一氯取代物有3种,其沸点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
A. 既作氧化剂又作还原剂
B. 既不作氧化剂又不作还原剂
C. 作还原剂
D. 作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是
A.氯水、盐酸、火碱、硫酸钡
B.水银、硫酸、烧碱、硫酸氢钠
C.铜、醋酸、石灰石、氯化铜
D.臭氧、硝酸、纯碱、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,A完全燃烧后生成m(CO2):m(H2O)=22:9,A在同系物中相对分子质量最小。现有如下图转化关系:

请回答:
(1)有机物A中含有的官能团名称为_________。
(2)有机物F与氢氧化钠溶液反应的化学方程式为_____________。
(3)有机物E能使溴的四氯化碳溶液褪色,其原因是_________(用化学方程式表示)。
(4)下列说法不正确的是_________
A.B![]() C可通过如下两步直接实现:①热铜丝催化氧化,②直接与新制Cu(OH)2共热
C可通过如下两步直接实现:①热铜丝催化氧化,②直接与新制Cu(OH)2共热
B.将绿豆大小的钠投入到B中,钠块浮在液面上,并产生气泡
C.若C![]() E为加成反应,则D为乙炔
E为加成反应,则D为乙炔
D.为制备干燥的F,可在分离出F后,选用碱石灰做干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用物质的量浓度为0.100 0 mol·L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂。请填写下列空白:
(1) 用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液_________________,立即停止滴定。
(2) 下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出

(3) 若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为 mL。若仰视,会使读数偏___________(填“大”或“小”)。
(4) 再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是 mol·L-1。
滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com