
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为2:1,以下说法不正确的是( )
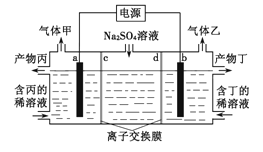
A.a极与电源的负极相连
B.离子交换膜d为阴离子交换膜
C.产物丙为硫酸溶液
D.a电极反应式:2H2O+2e-=H2↑+2OH-
科目:高中化学 来源: 题型:
【题目】根据图,下列判断中正确的是

A.向烧杯a中加入少量KOH溶液,有白色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ=2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H++ 4eˉ= 2H2O,溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为 N2(g)+3H2(g) ![]() 2NH3(g)△H=+92.4kJmol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJmol﹣1,下列说法正确的是( )
A.一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态
B.取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3
C.一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小
D.一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属溴与氯气的性质很相似。在探究溴单质的性质时,其基本程序应该是
A. 做实验并观察实验现象→分析、解释,得出结论
B. 观察溴的外观性质→做实验并观察实验现象→分析、解释,得出结论
C. 观察溴的外观性质→预测溴的化学性质→做实验并观察实验现象→分析、解释,得出结论
D. 预测溴的性质→做实验并观察实验现象→分析、解释,得出结论→观察溴的外观性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为化学常见的纯净物,A是单质.它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且C是造成酸雨的主要物质。B与C可反应生成A,写出该反应的化学方程式:
(2)若A是太阳能电池用的光伏材料,B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出B→C的离子方程式:
(3)若B为淡黄色固体,②③反应均用到同一种液态氢化物,D物质常用于食品工业。
B所含化学键的类型是 。写出B→C的化学方程式: .
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出C→D的离子方程式: .
(5)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。写出C→D的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是
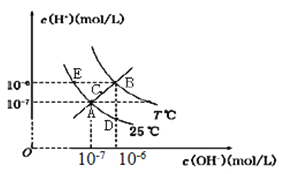
A.图中五点Kw间的关系:B>C>A=D=E
B.E点对应的水溶液中,可能有NH4+、Ba2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有: c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A点所示,则溶液中反应:2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com