
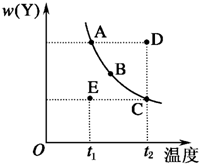
 对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
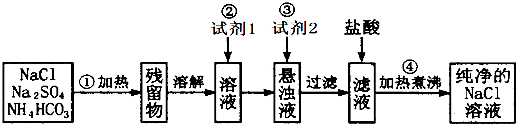
 某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.
某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.| ①沉降 |
| ②过滤 |
| ③曝气 |
| ④离子交换 |
| ⑤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
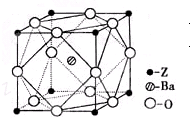 Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.已知:
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.已知:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
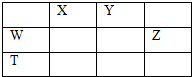
| A、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B、由X、Y和氢三种元素形成的化合物中只有共价键 |
| C、物质WY2,W3X4,WZ4均有熔点高,硬度大的特性 |
| D、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正反应为放热反应 |
| B、达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中所含的离子是:Fe2+、K+、SO42-、NO3- |
| B、实验③,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为18g |
| C、若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| D、若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液会显血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com